Estrongiloidiasis - Strongyloidiasis
| Estrongiloidiasis | |
|---|---|
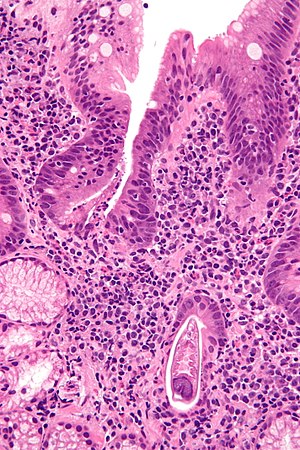 | |
| Micrografía que muestra estrongiloidiasis; se ve un fragmento de un gusano en la esquina inferior derecha. Mancha H&E . | |
| Especialidad |
Enfermedad infecciosa , helmintólogo |
| Síntomas | dolor abdominal , diarrea , pérdida de peso , picor y erupción |
| Complicaciones | Síndrome de hiperinfección |
| Causas | Strongyloides stercoralis |
| Factores de riesgo | Inmunocompromiso |
| Método de diagnóstico | Serología, pruebas de heces |
| Tratamiento | Ivermectina |
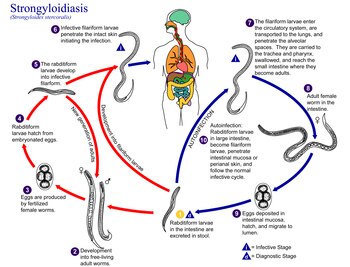
La estrongiloidiasis es una enfermedad parasitaria humana causada por el nematodo llamado Strongyloides stercoralis o, a veces, S. fülleborni, que es un tipo de helminto . Pertenece a un grupo de nematodos llamados lombrices intestinales . Esta lombriz intestinal puede causar una serie de síntomas en las personas, principalmente síntomas cutáneos, dolor abdominal , diarrea y pérdida de peso , entre muchos otros síntomas específicos y vagos en enfermedades diseminadas, y condiciones graves que ponen en peligro la vida por hiperinfección. En algunas personas, particularmente aquellas que requieren corticosteroides u otros medicamentos inmunosupresores, Strongyloides puede causar un síndrome de hiperinfección que puede conducir a la muerte si no se trata. El diagnóstico se realiza mediante análisis de sangre y heces. El medicamento ivermectina se usa ampliamente para tratar la estrongiloidiasis.
La estrongiloidiasis es un tipo de helmintiasis transmitida por el suelo . Las estimaciones bajas postulan que afecta de 30 a 100 millones de personas en todo el mundo, principalmente en países tropicales y subtropicales, mientras que las estimaciones más altas extrapolan de manera conservadora que la infección es superior a 370 millones de personas. Pertenece al grupo de las enfermedades tropicales desatendidas y los esfuerzos mundiales están dirigidos a erradicar la infección.
Signos y síntomas
La infección por Strongyloides se presenta en cinco formas. A medida que la infección continúa y las larvas maduran, pueden aparecer síntomas respiratorios ( síndrome de Löffler ). La infección puede volverse crónica con síntomas principalmente digestivos. En la reinfección (cuando las larvas migran a través del cuerpo) de la piel a los pulmones y finalmente al intestino delgado, puede haber síntomas respiratorios, cutáneos y digestivos. Finalmente, el síndrome de hiperinfección causa síntomas en muchos sistemas de órganos, incluido el sistema nervioso central .
Enfermedad no complicada
Con frecuencia asintomático . Los síntomas del sistema gastrointestinal incluyen dolor abdominal y diarrea y / o por el contrario estreñimiento . Los síntomas pulmonares (incluido el síndrome de Löffler ) pueden ocurrir durante la migración pulmonar de las larvas filariformes. Puede haber infiltrado pulmonar a través de una investigación radiológica. Las manifestaciones dermatológicas incluyen erupciones de urticaria en las nalgas y áreas de la cintura, así como currens de larvas . Generalmente se presenta eosinofilia . La estrongiloidiasis puede volverse crónica y luego volverse completamente asintomática.
Enfermedad diseminada
La estrongiloidiasis diseminada ocurre cuando los pacientes con estrongiloidiasis crónica se vuelven inmunodeprimidos . Debe hacerse una distinción entre diseminación e hiperinfección. Es principalmente una distinción semántica. Puede haber una diseminación leve donde la carga de gusanos es relativamente menor pero causa síntomas insidiosos, o una diseminación extrema que se usa para describir el término hiperinfección. Por tanto, la hiperinfección de diversos niveles de diseminación grave puede presentarse con dolor abdominal, distensión, shock , complicaciones pulmonares y neurológicas , sepsis , hemorragia , malabsorción y, dependiendo de la combinación, el grado, el número y la gravedad de los síntomas, es potencialmente mortal. Los gusanos ingresan al torrente sanguíneo desde la pared intestinal, permitiendo simultáneamente la entrada de bacterias intestinales como Escherichia coli . Esto puede causar síntomas como sepsis (infección del torrente sanguíneo) y las bacterias pueden diseminarse a otros órganos donde pueden causar una infección localizada como meningitis . La diseminación sin hiperinfección puede presentar en menor grado los síntomas anteriores y muchos otros.
La diseminación puede ocurrir muchas décadas después de la infección inicial y se ha asociado con dosis altas de corticosteroides , trasplante de órganos , cualquier otro caso y causa de inmunosupresión, VIH , lepra lepromatosa , sífilis terciaria , anemia aplásica , desnutrición, tuberculosis avanzada e intoxicación por radiación . A menudo se recomienda que los pacientes que comienzan con inmunosupresión se sometan a pruebas de detección de estrongiloidiasis crónica; sin embargo, esto a menudo no es práctico (las pruebas de detección a menudo no están disponibles) y en los países desarrollados, la prevalencia de estrongiloidiasis crónica es muy pequeña, por lo que la detección generalmente no es rentable, excepto en áreas endémicas. La realidad de los viajes globales y la necesidad de una atención médica moderna y avanzada, incluso en el llamado "mundo desarrollado", requiere que en áreas no endémicas haya pruebas y exámenes de detección fácilmente accesibles para enfermedades tropicales desatendidas como la estrongiloidiasis.
Es importante señalar que no necesariamente hay eosinofilia en la enfermedad diseminada. La ausencia de eosinofilia en una infección limitada al tracto gastrointestinal puede indicar un mal pronóstico. La eosinofilia suele estar ausente en la infección diseminada. Los esteroides también suprimen la eosinofilia, al tiempo que conducen a la diseminación y a la posible hiperinfección.
Las infecciones diseminadas intensificadas causadas por inmunosupresión pueden dar como resultado una amplia variedad y grado variable de síntomas dispares según la afección y otros aspectos biológicos del individuo, que pueden emular otras enfermedades o diagnósticos. Además de los muchos síntomas gastrointestinales palpables y otros síntomas variados, a menudo se presenta caquexia drástica en medio de lasitud, aunque pueden ocurrir infecciones diseminadas graves en individuos sin pérdida de peso, independientemente del índice de masa corporal .
Diagnóstico
El diagnóstico se basa en la identificación microscópica de larvas (rabditiformes y ocasionalmente filariformes) en las heces o en el líquido duodenal . El examen de muchas muestras puede ser necesario, y no siempre suficiente, porque el examen directo de las heces es relativamente insensible , y una sola muestra solo puede detectar larvas en aproximadamente el 25% de los casos. Pueden pasar 4 semanas desde la infección inicial hasta el paso de las larvas en las heces.
Las heces se pueden examinar en preparaciones húmedas :
- directamente
- después de la concentración (formalina-acetato de etilo)
- después de la recuperación de las larvas mediante la técnica del embudo de Baermann
- después del cultivo mediante la técnica del papel de filtro Harada-Mori
- después del cultivo en placas de agar
Las técnicas de cultivo son las más sensibles, pero no están disponibles de forma rutinaria en Occidente. En el Reino Unido, la cultura está disponible en cualquiera de las Escuelas de Medicina Tropical de Liverpool o Londres. El examen directo debe realizarse en las heces recién recolectadas y no se deja enfriar, porque los huevos de anquilostomas eclosionan al enfriarse y las larvas son muy difíciles de distinguir de Strongyloides .
Encontrar Strongyloides en las heces es negativo hasta en un 70% de las pruebas. Es importante someterse a muestras frecuentes de heces, así como a una biopsia duodenal si se sospecha una infección grave. El líquido duodenal puede examinarse mediante técnicas como la cuerda Enterotest o la aspiración duodenal. Pueden detectarse larvas en el esputo de pacientes con estrongiloidiasis diseminada.
Dada la escasa capacidad del examen de las heces para diagnosticar Strongyloides , la detección de anticuerpos mediante ELISA puede resultar útil. La serología puede tener reacciones cruzadas con otros parásitos, permanecer positiva durante años después de un tratamiento exitoso o ser falsamente negativa en pacientes inmunodeprimidos. Los pacientes infectados también suelen tener un recuento elevado de eosinófilos , con un promedio de recuento absoluto de eosinófilos de 1000 en una serie. La eosinofilia de una infección gastrointestinal puede fluctuar en respuesta a la producción de larvas, o puede faltar permanentemente en algunas infecciones diseminadas. Por lo tanto, la falta de eosinofilia no es evidencia de ausencia de infección. La combinación de sospecha clínica, un anticuerpo positivo y una eosinofilia periférica puede sugerir fuertemente una infección.
Sería de gran utilidad contar con avances significativos en la sensibilidad de los medios de diagnóstico, ya que también resolvería el desafiante problema de la prueba de curación. Si se resuelve el diagnóstico definitivo, es lógico pensar que la prueba de la cura se vuelve fácilmente realizable.
Tratamiento
El fármaco de consenso de elección para el tratamiento de la estrongiloidiasis no complicada es la ivermectina . Sin embargo, incluso si se considera el principal fármaco de elección, estudios recientes han ilustrado los desafíos de la ivermectina para curar la estrongiloidiasis. La ivermectina no mata las larvas de Strongyloides , solo los gusanos adultos, por lo que puede ser necesario repetir la dosificación para erradicar adecuadamente la infección. Existe un ciclo autoinfeccioso de aproximadamente dos semanas en el que se debe volver a administrar la ivermectina; sin embargo, puede ser necesaria una dosis adicional ya que no matará Strongyloides en la sangre o larvas en lo profundo de los intestinos o divertículos. Otros fármacos que pueden ser eficaces son el albendazol y el tiabendazol (25 mg / kg dos veces al día durante 5 días; máximo 400 mg (en general)). Todos los pacientes con riesgo de estrongiloidiasis diseminada deben recibir tratamiento. La duración óptima del tratamiento para pacientes con infecciones diseminadas no está clara.
El tratamiento de la estrongiloidiasis puede ser difícil y si se interrumpe el tratamiento antes de que se elimine por completo, se sabe que Strongyloides a través del ciclo autoinfeccioso vive en los individuos durante décadas; incluso después de un tratamiento sostenido inicial o inadecuado. Por lo tanto, puede ser necesario un tratamiento continuo, control de sangre y heces incluso si los síntomas se resuelven temporalmente. Como se mencionó anteriormente, debido al hecho de que algunas infecciones son insidiosamente asintomáticas, y los análisis de sangre relativamente costosos a menudo no son concluyentes a través de falsos positivos o falsos negativos, así como las muestras de heces pueden no ser confiables en el diagnóstico, lamentablemente todavía no existe un estándar de oro real para prueba de cura, reflejando la falta de una metodología de diagnóstico eficiente y confiable. Un estándar de erradicación objetivo para la estrongiloidiasis es difícil de alcanzar dado el alto grado de sospecha necesario incluso para comenzar el tratamiento, la dificultad a veces de los únicos criterios de diagnóstico definitivos para detectar y aislar larvas o Strongyloides adultos , la importancia del diagnóstico temprano, particularmente antes de los tratamientos con esteroides, y la gran variabilidad y exclusión / inclusión de diferentes colecciones de síntomas difusos. Haciendo caso omiso de la atribución errónea de los trastornos de parasitosis delirantes auténticos, la estrongiloidiasis debería ser más conocida entre los profesionales médicos y tener una seria consideración para las campañas educativas amplias en lugares geográficos afectados tanto dentro del mundo desarrollado semitropical como en otros países, así como en el mundo tropical en desarrollo donde , entre muchas otras enfermedades tropicales desatendidas, es endémica.
Se necesitan programas gubernamentales para ayudar a descontaminar las áreas endémicas y ayudar a las poblaciones afectadas de la infección. Además, se requiere progreso en el establecimiento de apoyo financiero para facilitar y cubrir medicamentos asequibles para personas en regiones y comunidades afectadas en riesgo para ayudar a continuar con los tratamientos.
Hay informes contradictorios sobre tratamientos farmacológicos eficaces. Se ha documentado la ineficacia de la ivermectina y el aumento de la resistencia a los medicamentos . La OMS señala que el albendazol es el menos eficaz. El tiabendazol puede tener efectos secundarios graves y no está disponible en muchos países. Se requieren grandes avances para avanzar en el desarrollo de medicamentos y protocolos de medicamentos exitosos para la estrongiloidiasis y otras enfermedades tropicales desatendidas.
El contagio a través de los textiles, a diferencia de Enterobius vermicularis , es infundado. Como es, en general, contagio de persona a persona de una infección asintomática y diseminada. Rara vez se ha transmitido a través del trasplante de órganos. Los veteranos casados de la Guerra de Vietnam que estaban infectados, pero que nunca desarrollaron una hiperinfección significativa, vivieron durante varias décadas con una infección diseminada no debilitante, sin tratamiento, con esposas que nunca contrajeron la infección. La contracción se produce abrumadoramente por la exposición de la piel a cualquier suelo contaminado, tierra para macetas contaminada, aguas contaminadas, falta de saneamiento o factores ambientales como vectores potenciales. Casi nunca o extraordinariamente muy raras veces se documenta la transmisión de persona a persona (además del sexo homosexual masculino infectado), aparte de la cercanía del contacto con la tos productiva de un individuo hiperinfectado muy enfermo. Se ha demostrado que es posible que ocurra en esa situación, o potencialmente en otros escenarios similares, se especula a través de las secreciones pulmonares de un individuo extremadamente hiperinfectado. En cuyo caso, se podrá indicar el tratamiento de otras personas, si se considera necesario por proximidad, síntomas, precauciones, probables exposiciones a los mismos vectores, o mediante el cribado de muestras serológicas y de heces, hasta erradicar la infección.
Antes de administrar esteroides, se recomienda al menos un poco de detección de infecciones en individuos potencialmente susceptibles de manera remota para evitar que la infección se intensifique. Como no hacerlo, en determinadas cohortes puede haber tasas de mortalidad extremadamente altas debido a una hiperinfección provocada inadvertidamente a través de la inmunosupresión de la aplicación de ciertos esteroides. Por tanto, la extrema precaución con respecto a los riesgos iatrogénicos es fundamental para evitar muertes u otras consecuencias adversas en el tratamiento, que por supuesto prefiguran un diagnóstico correcto. Las personas con una alta exposición a Strongyloides stercoralis pueden mitigar el riesgo de hiperinfección por estrongiloidiasis asociada con el tratamiento con corticosteroides, con el uso presuntivo de ivermectina. Tal hiperinfección ha sido una preocupación particular durante la pandemia de COVID-19 debido al uso de corticosteroides para el tratamiento de los síntomas de COVID-19. Los CDC y otros organismos internacionales recomiendan el uso de ivermectina para refugiados de áreas que tienen riesgo de estrongiloidiasis.
Durante la década de 1940, el tratamiento de elección fueron comprimidos con cubierta entérica de 60 mg de violeta de genciana , tres veces al día, durante 16 días. Se informó que la tasa de curación era solo de 50 a 70 por ciento, lo que requería ciclos repetidos. Es posible que la tasa de curación sea incluso menor que la publicada en la literatura, debido a la dificultad de diagnosticar positivamente la infección.
Epidemiología
Las estimaciones bajas postulan que afecta de 30 a 100 millones de personas en todo el mundo, principalmente en países tropicales y subtropicales, mientras que las estimaciones más altas extrapolan de manera conservadora que la infección es superior a 370 millones de personas. Pertenece al grupo de las enfermedades tropicales desatendidas y los esfuerzos mundiales están dirigidos a erradicar la infección.
Historia
La enfermedad fue reconocida por primera vez en 1876 por el médico francés Louis Alexis Normand, que trabajaba en el hospital naval de Toulon ; identificó los gusanos adultos y los envió a Arthur Réné Jean Baptiste Bavay, inspector jefe de salud, quien observó que estas eran las formas adultas de las larvas encontradas en las heces. En 1883, el parasitólogo alemán Rudolf Leuckart hizo observaciones iniciales sobre el ciclo de vida del parásito, y el médico belga Paul Van Durme (basándose en observaciones del parasitólogo alemán Arthur Looss ) describió el modo de infección a través de la piel. El parasitólogo alemán Friedrich Fülleborn describió la autoinfección y la forma en que la estrongiloidiasis afecta al intestino. El interés por la enfermedad aumentó en la década de 1940 cuando se descubrió que quienes habían adquirido la infección en el extranjero y luego habían recibido inmunosupresión desarrollaron el síndrome de hiperinfestación.
Referencias
enlaces externos
| Clasificación | |
|---|---|
| Recursos externos |