Receptor de interferón-alfa / beta - Interferon-alpha/beta receptor
| receptor 1 de interferón (alfa, beta y omega) | |||||||
|---|---|---|---|---|---|---|---|
| Identificadores | |||||||
| Símbolo | IFNAR1 | ||||||
| Alt. simbolos | IFNAR | ||||||
| Gen NCBI | 3454 | ||||||
| HGNC | 5432 | ||||||
| OMIM | 107450 | ||||||
| RefSeq | NM_000629 | ||||||
| UniProt | P17181 | ||||||
| Otros datos | |||||||
| Lugar | Chr. 21 q22.1 | ||||||
| |||||||
| receptor 2 de interferón (alfa, beta y omega) | |||||||
|---|---|---|---|---|---|---|---|
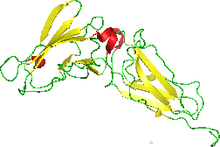
Estructura de RMN del ectodominio de unión a interferón del receptor de interferón humano.
| |||||||
| Identificadores | |||||||
| Símbolo | IFNAR2 | ||||||
| Alt. simbolos | IFNABR | ||||||
| Gen NCBI | 3455 | ||||||
| HGNC | 5433 | ||||||
| OMIM | 602376 | ||||||
| RefSeq | NM_207585 | ||||||
| UniProt | P48551 | ||||||
| Otros datos | |||||||
| Lugar | Chr. 21 q22.1 | ||||||
| |||||||
El receptor de interferón-α / β (IFNAR) es un receptor de membrana prácticamente ubicuo que se une a citocinas de interferón de tipo I (IFN) endógenas . Los IFN de tipo I endógenos humanos incluyen muchos subtipos, tales como interferones-α, -β, -ε, -κ, -ω y -ζ.
Función
La activación de varias vías de señalización inmunes innatas ( TLR3 , TLR4 , TLR7 , TLR8 , TLR9 , cGAS , RIG-I , MDA-5 ) conduce a la rápida inducción de IFN de tipo I debido a su estructura genética (en su mayoría) sin intrones. Los elementos reguladores corriente arriba de los genes de IFN de tipo I difieren, lo que permite la transcripción diferencial de los IFN de tipo I en respuesta a los estímulos. En particular, el IFNβ contiene un sitio regulador de κB, mientras que los subtipos de IFNα no. La producción de IFN de tipo I específicos generalmente se limita a un pequeño número de subtipos de IFN de tipo I. Una vez secretados, los IFN de tipo I envían señales a través de IFNAR de manera paracrina y autocrina .
IFNAR es un receptor de superficie celular heteromérico compuesto por dos subunidades, denominadas subunidad de baja afinidad, IFNAR1 , y subunidad de alta afinidad, IFNAR2 . Tras la unión de los interferones de tipo I, IFNAR activa la vía de señalización JAK-STAT , junto con las vías de señalización MAPK , PI3K y Akt . El agonismo de IFNAR da como resultado cambios transcripcionales, con el potencial de aumentar o suprimir la transcripción de más de 2000 genes diferentes. Por ejemplo, los IFN de tipo I inducen la expresión del gen estimulado por interferón ( ISG ), lo que clásicamente da como resultado una sólida respuesta inmunitaria antiviral. Además, los IFN impactan en gran medida la salud y la viabilidad celular, con efectos sobre la apoptosis , la autofagia , la diferenciación celular y la proliferación. Los diversos efectos de los IFN de tipo I probablemente dependan del contexto celular y ambiental.
Se han estudiado diferentes respuestas, por ejemplo, respuestas antivirales frente a antiproliferativas, a los subtipos de IFN de tipo I y la señalización proximal, como la fosforilación STAT , no parece correlacionarse con el resultado. Además, aunque los efectos diferenciales se manifiestan después de varios días de estimulación crónica, los cambios en la estructura, orientación o estequiometría del receptor no han dilucidado la causa de la señalización diferencial a través de diferentes subtipos de IFN de tipo I. Las hipótesis actuales para la señalización diferencial incluyen diferencias específicas de ligando en la estabilidad, o vida útil, del complejo ternario, cambios inducidos por ligando en la internalización y tráfico del receptor y diferencias actualmente no apreciadas en la estructura ligando-receptor.
Estructura
El receptor de IFN de tipo I forma un complejo ternario, compuesto por sus dos subunidades IFNAR1 e IFNAR2, y un ligando de IFN de tipo I. La unión del ligando a cualquiera de las subunidades es necesaria y precede a la dimerización y activación del receptor. Cada subunidad de IFNAR contiene un dominio de unión a ligando N-terminal (con dos o cuatro subdominios similares a fibronectina tipo II, para IFNAR2 e IFNAR1, respectivamente), un dominio transmembrana (TM) y un dominio citoplásmico. Cada ligando de IFN de tipo I contiene un "hotspot", o una secuencia de aminoácidos conservados que participan en la unión al receptor, específicamente el receptor de alta afinidad IFNAR2, que determina la afinidad de cada ligando por el receptor.
El análisis estructural del receptor de IFN de tipo I con diferentes subtipos de ligando de IFN de tipo I reveló un sitio de unión similar para los diferentes agonistas. Los estudios de mutagénesis de los IFN de tipo I, IFNAR1 e IFNAR2 demostraron importantes residuos de unión, es decir, "puntos calientes", en los subtipos de IFN de tipo I que influyeron en su capacidad para unirse a IFNAR2. La unión de IFN de tipo I a IFNAR1 se vio menos afectada por la mutación de aminoácidos individuales a alanina. Es importante destacar que los estudios estructurales no han revelado diferencias en las estructuras complejas ternarias con IFNAR y varios subtipos de IFN de tipo I, a pesar de las diferencias en las afinidades del ligando. La conservación evolutiva de los subtipos de IFN de tipo I que se unen al mismo receptor de IFNAR en el mismo sitio con afinidades diferentes sugiere que los IFN de tipo I no son redundantes y regulan potencialmente diferentes respuestas celulares. Los esfuerzos para diseñar un IFNα2 más potente provocaron una respuesta celular similar al IFNβ, lo que sugiere que la afinidad de los IFN de tipo I por el IFNAR tiene un papel importante en la regulación de la respuesta aguas abajo.
Subunidades
Los genes IFNAR1 e IFNAR2 humanos se encuentran en el cromosoma 21q22.1.
IFNAR1
IFNAR1 es la subunidad de baja afinidad, originalmente clonada en 1990, y está compuesta por cuatro subdominios similares a fibronectina tipo II (similares a FNII), denominados SD1-4. Los IFN de tipo I se unen a SD1-3 con una afinidad de unión típica de entre 0,5 y 5 μM; IFNα1 e IFNβ son excepciones con afinidades de unión de 220 nM y 100 nM, respectivamente. Los IFN de tipo I tienen una tasa de asociación de unión de 5x10 5 M / s con una tasa de disociación variable que determina la afinidad del subtipo de IFN de tipo I por IFNAR1.
El dominio citoplásmico de IFNAR1 se asocia con Tyk2 y se requiere Tyk2 para la expresión de IFNAR1 en la membrana. En ausencia de Tyk2, un motivo IFNAR1 citoplásmico se fosforila, lo que induce la internalización del receptor. El IFNAR1 luego se localiza en el compartimento endosómico perinuclear y se degrada. Las células nulas Tyk2 conservan cierta capacidad de respuesta al IFNβ. Sin embargo, la capacidad de respuesta al IFNα se elimina, probablemente debido a la expresión reducida de la membrana de IFNAR1. Se ha propuesto que la unión de IFNAR1 a ligandos de baja afinidad, como los subtipos de IFNα, es el paso limitante de la velocidad en la formación del complejo ternario. Por lo tanto, si los niveles de membrana de IFNAR1 son demasiado bajos, el complejo binario IFNα-IFNAR2 no podrá reclutarlo para inducir la señalización. Esta hipótesis está respaldada por observaciones de que las líneas celulares con baja expresión de IFNAR1 responden a IFNβ pero no a IFNα.
IFNAR2
IFNAR2 es la subunidad de alta afinidad, originalmente clonada en 1994, compuesta por dos subdominios similares a FNII, denominados D1 y D2. Los IFN de tipo I se unen a D1 y D2 con una afinidad de unión típica de entre 0,4 y 5 nM; El IFNβ se une con una afinidad ligeramente menor (0,1 nM). Los IFN de tipo I tienen una tasa de asociación de unión de 10 −6 a 10 −7 M / s con una tasa de disociación variable que determina la afinidad del subtipo de IFN de tipo I por IFNAR2.
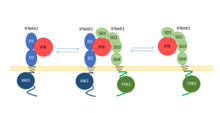
El IFNAR2 se expresa como tres isoformas debido al empalme alternativo, omisión de exón y múltiples sitios de poliadenilación; IFNAR2a (una forma soluble que carece del dominio TM), IFNAR2b (una forma soluble que carece del dominio citoplasmático) e IFNAR2c (la forma competente en señalización unida a la membrana). El dominio citoplasmático de IFNAR2c se asocia con JAK1 .
Señalización
Los IFN de tipo I se unen a IFNAR1 o IFNAR2, formando un complejo binario. El complejo binario recluta aún más la subunidad IFNAR restante, completando el complejo ternario y activando la señalización JAK / STAT corriente abajo . La unión de IFN a IFNAR acerca a las quinasas asociadas al receptor, JAK1 y Tyk2, lo que da como resultado la transfosforilación de quinasas y la posterior fosforilación de tirosinas en IFNAR1 e IFNAR2. Los residuos de fosfotirosina en IFNAR1 e IFNAR2 reclutan proteínas STAT (clásicamente STAT1 , STAT2 o STAT3 , aunque STAT4 , STAT5 y STAT6 pueden desempeñar un papel en ciertos tipos de células) a través de sus dominios SH2 . Una vez reclutadas, las proteínas STAT se fosforilan, lo que induce su homo o heterodimerización. Estos dímeros se trasladan al núcleo, uniendo elementos de respuesta estimulados por interferón (ISRE) y secuencias de activación gamma (GAS), promoviendo la transcripción de genes.
Regulación
En condiciones normales, los niveles de IFN de tipo I se regulan homeostáticamente para equilibrar los beneficios de la protección contra la infección viral con los otros efectos celulares asociados con la señalización de IFN de tipo I, como la apoptosis, la detención del ciclo celular y la modulación inmunitaria. La estricta regulación de la señalización de IFN tipo I sugiere la importancia de la sincronización y la ubicación. La señalización de IFN de tipo I se controla a través de varios mecanismos, incluida la expresión diferencial de los componentes de señalización, la señalización diferencial después de la participación de IFNAR, la endocitosis y la regulación a la baja de los receptores. y mecanismos de retroalimentación negativa
Expresión diferencial
La capacidad de respuesta a los IFN de tipo I requiere la expresión de componentes de señalización dentro de una célula objetivo determinada, incluidos IFNAR y STAT. Los niveles de expresión y las modificaciones postraduccionales de IFNAR y STAT pueden modificar la capacidad de respuesta celular. Es importante destacar que la señalización se ve afectada por diferentes niveles de expresión de la proteína STAT y la activación de heterodímeros STAT y homodímeros STAT; la reducción de los niveles de expresión de STAT altera las respuestas antivirales, antiproliferativas e inflamatorias a los IFN de tipo I. Por el contrario, el aumento de la expresión de STAT1 e IRF9 mantiene la expresión de ISG, incluso en ausencia de señalización del receptor de citoquinas en curso, amplificando así la señalización de IFNAR. Dado que la señalización del IFN de tipo I modula las proteínas implicadas en la traducción de proteínas, también puede alterar indirectamente los niveles de proteínas de los genes inducidos y las proteínas implicadas en la señalización de la vía.
Los subtipos de IFN de tipo I, que varían de 30 a 70% de homología, se unen todos al mismo receptor. El agonismo sesgado se ha estudiado para comprender mejor cómo un solo receptor responde de manera diferente a múltiples ligandos afines, lo que culmina en resultados dispares.
Endocitosis y regulación negativa
IFNAR1 e IFNAR2 pueden internalizarse mediante endocitosis en respuesta al agonismo a través de mecanismos dependientes e independientes de clatrina. Las subunidades de IFNAR se pueden regular a la baja diferencialmente después de la estimulación con IFN. Por ejemplo, el IFNAR1 de membrana se reduce en respuesta a IFNα, pero los niveles de superficie IFNAR1 e IFNAR2 se regulan negativamente en respuesta a la unión de IFNβ. De acuerdo con estas observaciones, la internalización de IFNAR se asocia a menudo con la capacidad del agonista respectivo para inducir un efecto antiproliferativo.
La internalización de la subunidad de IFNAR también se observa en condiciones basales, con mayor recambio basal de IFNAR1 que de IFNAR2. IFNAR1 contiene un degron, o un motivo de ubiquitinación, que permite su internalización y degradación. Tyk2 puede bloquear este degron, evitando su internalización.
Endocitosis dependiente de clatrina
Después del agonismo del receptor, el extremo C-terminal de IFNAR se fosforila, seguido de su ubiquitinación e internalización. La expresión de la superficie de IFNAR se mantiene en presencia de estimulación cuando la vía de endocitosis dependiente de clatrina se inhibe con la eliminación de ARNip de clatrina o usando un inhibidor de molécula pequeña de la dinamina GTPasa . La internalización puede resultar en la degradación del receptor, reduciendo así la expresión de la membrana, o puede resultar en el reciclaje del receptor sin un impacto prolongado en los niveles del receptor de la membrana. Sin embargo, la endocitosis mediada por clatrina también puede servir para concentrar los receptores IFNAR y los componentes de señalización, amplificando así la señalización. Los experimentos de microscopía electrónica muestran receptores de IFNAR concentrados en fosas recubiertas de clatrina, y la inhibición de la endocitosis mediada por clatrina resultó en una reducción de la fosforilación de JAK1, Tyk2, STAT y una reducción de la translocación nuclear de STAT.
Mecanismos de retroalimentación negativa
Los reguladores negativos de la señalización de IFN de tipo I, como el supresor de la señalización de citoquinas 1 (SOCS1) y la peptidasa 18 específica de ubiquitina ( USP18 ), se inducen después de 4 horas. SOCS1 inhibe la señalización de IFN de tipo I inhibiendo las JAK y uniendo Tyk2 fosforilado. USP18 se une al terminal C de IFNAR2. La USP18 puede regular la señalización de IFN de tipo I al interferir con la formación del complejo ternario, no a través de su función peptidasa. La pérdida de USP18 da como resultado una enfermedad inflamatoria del SNC mediada por interferón.
Implicaciones clínicas
El IFN de tipo I puede proporcionar efectos tanto beneficiosos como perjudiciales en una variedad de enfermedades. Se cree que el IFN tipo I es un impulsor de múltiples enfermedades autoinmunes y puede tener un papel en la infección crónica. Por el contrario, los IFN de tipo I también se prescriben como agentes terapéuticos en otras indicaciones de enfermedad.
En particular, el IFN de tipo I está implicado en la patogenia de las siguientes enfermedades autoinmunes: lupus eritematoso sistémico (LES), síndrome de Sjogren , esclerosis sistémica , artritis reumatoide (AR) y miositis . También se cree que el aumento de los niveles de IFNα intracerebral juega un papel perjudicial en el síndrome de Aicardi-Goutières (AGS), la demencia asociada al VIH y el lupus del SNC. Si bien los IFN de tipo I son una de las citocinas clásicas necesarias para una respuesta antiviral eficaz, los niveles más altos de IFN de tipo I se asocian con un empeoramiento de la enfermedad en las infecciones bacterianas, como la tuberculosis y la lepra lepromatosa . El IFN de tipo I también se está investigando por su posible papel en la neurodegeneración; la pérdida de la expresión de IFNAR prolongó la supervivencia en modelos murinos de esclerosis lateral amiotrófica (ELA).
El IFNα también se ha utilizado en la clínica para el tratamiento de neoplasias hematológicas que responden al IFN de tipo I, como la leucemia mielógena crónica (LMC), el mieloma múltiple y la leucemia de células pilosas . Es importante destacar que se ha demostrado que los cánceres resistentes a IFN de tipo I tienen una expresión de IFNAR baja o ausente. Además, IFNa se le dio también terapéuticamente para el tratamiento de algunas infecciones virales potencialmente crónicas, tales como hepatitis B y hepatitis C . Paradójicamente, el IFNβ fue el tratamiento de primera línea para la enfermedad autoinmune central, la esclerosis múltiple (EM), aunque el mecanismo de acción del IFNβ en la EM no se ha demostrado definitivamente.
Referencias
enlaces externos
- Receptor, + interferón + alfa-beta en los encabezados de temas médicos (MeSH) de la Biblioteca Nacional de Medicina de EE. UU .
