Carne cultivada - Cultured meat
La carne cultivada es una carne producida por cultivos celulares in vitro de células animales. Es una forma de agricultura celular .
La carne cultivada se produce utilizando técnicas de ingeniería de tejidos tradicionalmente utilizadas en medicinas regenerativas . El concepto de carne cultivada fue popularizado por Jason Matheny a principios de la década de 2000 después de ser coautor de un artículo sobre la producción de carne cultivada y crear New Harvest , la primera organización sin fines de lucro del mundo dedicada a la investigación de la carne in vitro .
La carne cultivada tiene el potencial de abordar problemas globales sustanciales del impacto ambiental de la producción de carne , el bienestar animal , la seguridad alimentaria y la salud humana .
En 2013, el profesor Mark Post de la Universidad de Maastricht fue pionero en una prueba de concepto para la carne cultivada al crear la primera hamburguesa cultivada directamente a partir de células. Desde entonces, otros prototipos de carne cultivada han ganado la atención de los medios: SuperMeat abrió un restaurante de laboratorio llamado "The Chicken" en Tel Aviv para probar la reacción de los consumidores a su hamburguesa "Chicken", mientras se realizaba la "primera venta comercial del mundo de carne de cultivo celular". en diciembre de 2020 en el restaurante de Singapur "1880", donde se vendía carne cultivada fabricada por la firma estadounidense Eat Just .
Si bien la mayoría de los esfuerzos en el espacio se centran en carnes comunes como el cerdo, la ternera y el pollo, que comprenden la mayor parte del consumo en los países desarrollados, algunas empresas nuevas como Orbillion Bio se han centrado en carnes de alta gama o inusuales, como Elk, Lamb, Bison, y la preciada cepa de ternera Wagyu. Avant Meats ha llevado al mercado pescado de mero cultivado a medida que otras empresas han comenzado a cultivar especies de pescado adicionales y otros mariscos.
El proceso de producción está en constante evolución, impulsado por múltiples empresas e instituciones de investigación . Las aplicaciones de la carne cultivada han dado lugar a discusiones éticas , sanitarias , medioambientales , culturales y económicas .
Nomenclatura
Además de la carne cultivada , los términos carne saludable , carne libre de masacre , in vitro carne , carne-vat adulto , carne-lab adulto , carne basado en células , carne limpia , carne cultivada y carne sintética se han utilizado para describir el producto.
Entre 2016 y 2019, la carne limpia ganó fuerza. El Good Food Institute (GFI) acuñó el término en 2016 y, a fines de 2018, el instituto publicó una investigación que afirmaba que el uso de productos limpios reflejaba mejor el proceso de producción y los beneficios. Para 2018 había superado lo cultivado e " in vitro " en menciones en los medios y búsquedas en Google. Algunas partes interesadas de la industria sintieron que el término empañaba innecesariamente a los productores de carne convencionales y seguían prefiriendo la carne a base de células como alternativa neutral.
En septiembre de 2019, GFI anunció una nueva investigación que encontró que el término carne cultivada es suficientemente descriptivo y diferenciador, posee un alto grado de neutralidad y ocupa un lugar destacado en el atractivo del consumidor. Una encuesta de septiembre de 2021 realizada por GFI indicó que la mayoría de los directores ejecutivos de la industria tienen preferencia por la carne cultivada , y el 75 por ciento de las 44 empresas la prefieren.
Historia
Investigación inicial
La posibilidad teórica de cultivar carne en un entorno industrial ha capturado durante mucho tiempo la imaginación del público. En su ensayo de 1931, Cincuenta años por lo tanto, Winston Churchill escribió: "Escaparemos del absurdo de hacer crecer un pollo entero para que se coma la pechuga o el ala, cultivando estas partes por separado en un medio adecuado".
En la década de 1950, al investigador holandés Willem van Eelen se le ocurrió de forma independiente la idea de la carne cultivada. Como prisionero de guerra durante la Segunda Guerra Mundial , Van Eelen sufrió de hambre, lo que lo llevó a ser un apasionado de la producción de alimentos y la seguridad alimentaria de adulto. Posteriormente asistió a la Universidad de Amsterdam. En un momento, asistió a una conferencia sobre las perspectivas de la carne en conserva. Junto con el descubrimiento de líneas celulares a principios de siglo, esto enriqueció la idea de carne cultivada.
El cultivo in vitro de fibras musculares se realizó con éxito por primera vez en 1971 cuando el profesor de patología Russel Ross cultivó aorta de cobaya . Él reportó,
El músculo liso derivado de la media interna y la íntima de la aorta de cobaya inmadura se cultivó durante hasta 8 semanas en cultivo celular . Las células mantuvieron la morfología del músculo liso en todas las fases de su crecimiento en cultivo. Después de crecer hasta la confluencia, crecieron en múltiples capas superpuestas. En la semana 4 de cultivo, aparecieron microfibrillas (110 A) dentro de los espacios entre las capas de células. El material similar a la membrana basal también apareció adyacente a las células. El análisis de las microfibrillas mostró que tienen una composición de aminoácidos similar a la de la proteína microfibrilar de la fibra elástica intacta. Estas investigaciones, junto con las observaciones radioautográficas de la capacidad de un músculo liso aórtico para sintetizar y secretar proteínas extracelulares, demuestran que esta célula es una célula sintética de tejido conectivo ".
En 1991, Jon F. Vein de los Estados Unidos solicitó y finalmente obtuvo la patente US 6835390 para la producción de carne modificada con tejidos para consumo humano, en la que el músculo y la grasa se cultivarían de manera integrada para crear productos alimenticios.
En 2001, el dermatólogo Wiete Westerhof de la Universidad de Amsterdam , el investigador y empresario Willem van Eelen y el empresario Willem van Kooten anunciaron que habían solicitado una patente mundial sobre un proceso para producir carne cultivada. En el proceso, se siembra una matriz de colágeno con células musculares , que luego se bañan en una solución nutritiva y se induce a dividirse.
Ese mismo año, la NASA comenzó a realizar experimentos con carne cultivada, con la intención de permitir que los astronautas que viajaban lejos cultivaran carne sin sacrificar el almacenamiento. En asociación con Morris Benjaminson de Turro College, pudieron cultivar trozos de peces de colores y más tarde, pavo.
En 2003, Oron Catts e Ionat Zurr del Tissue Culture and Art Project y la Escuela de Medicina de Harvard exhibieron en Nantes un "filete" de unos centímetros de ancho, cultivado a partir de células madre de rana , que se cocinaba y se comía. El objetivo de la exposición era iniciar una conversación en torno a la ética de la carne cultivada: "¿estuvo viva alguna vez?", "¿Alguna vez lo mataron?", "¿Es de alguna manera una falta de respeto para un animal tirarlo?"
A principios de la década de 2000, el estudiante estadounidense de salud pública Jason Matheny viajó a la India y visitó una granja industrial de pollos. Desde una perspectiva de salud pública, estaba consternado por las implicaciones de este sistema para los consumidores humanos. Al regresar a los Estados Unidos, Matheny se asoció con 3 científicos involucrados en el esfuerzo de la NASA para cultivar carne. Los cuatro comenzaron una investigación sobre carne de laboratorio. Publicaron sus hallazgos en 2005, la primera literatura revisada por pares sobre el tema. En 2004, Matheny fundó New Harvest, cuyo objetivo es fomentar el desarrollo en el campo mediante la financiación de la investigación pública.
En 2008, PETA ofreció un premio de 1 millón de dólares a la primera empresa en llevar carne de pollo cultivada en laboratorio a los consumidores para 2012. El concursante debía completar dos tareas antes de recibir el premio: "Producir un producto de carne de pollo cultivada que no se distinga del real pollo "y" Producir el producto en cantidades lo suficientemente grandes como para venderlo de manera competitiva en al menos 10 estados ". El concurso se extendió posteriormente hasta el 4 de marzo de 2014. Desde que se anunció por primera vez el desafío en 2008, los investigadores de todo el mundo han logrado avances significativos, aunque nada ha llegado al mercado masivo. La fecha límite finalmente expiró sin un ganador.
En 2008, el gobierno holandés invirtió 4 millones de dólares en experimentos relacionados con la carne cultivada. El Consorcio de Carne In Vitro, un grupo formado por investigadores internacionales, realizó la primera conferencia internacional sobre el tema, auspiciada por el Instituto de Investigación Alimentaria de Noruega en abril de 2008. La revista Time declaró la producción de carne cultivada como una de las 50 ideas innovadoras de 2009 En noviembre de 2009, científicos de los Países Bajos anunciaron que habían logrado cultivar carne utilizando células de un cerdo vivo.
Primer juicio público

La primera hamburguesa de carne de res cultivada fue creada por Mark Post en la Universidad de Maastricht en 2013. Se hizo con más de 20,000 hebras delgadas de tejido muscular, costó más de $ 300,000 y necesitó 2 años para producirse. En 2019 se estimó que el precio bajaría a $ 10 para 2021.
La hamburguesa fue probada en la televisión en vivo en Londres el 5 de agosto de 2013. Fue cocinada por el chef Richard McGeown de Couch's Great House Restaurant, Polperro , Cornwall, y degustada por los críticos Hanni Rützler , un investigador de alimentos del Future Food Studio, y Josh Schonwald. . Rützler dijo: "Realmente tiene un mordisco, hay bastante sabor con el dorado. Sé que no tiene grasa, así que no sabía realmente qué tan jugoso sería, pero tiene un sabor bastante intenso; es parecido a la carne, no es tan jugoso, pero la consistencia es perfecta. Esto es carne para mí ... Realmente es algo para morder y creo que el aspecto es bastante similar ". Rützler agregó que incluso en una prueba a ciegas habría tomado el producto por carne en lugar de una copia de soja .
Desarrollo de la industria
Es solo cuestión de tiempo antes de que esto suceda, estoy absolutamente convencido de eso. En nuestro caso, calculo que el tiempo será de aproximadamente 3 años antes de que estemos listos para ingresar al mercado a pequeña escala, aproximadamente 5 años para ingresar al mercado a mayor escala, y si me preguntan: "¿Cuándo [ carne cultivada] estar en el supermercado a la vuelta de la esquina? " Eso estará más cerca de 10 que de 5 años, creo.
- Peter Verstrate, Mosa Meat (2018)
Entre 2011 y 2017, se lanzaron muchas empresas emergentes de carne cultivada. Memphis Meats , una startup de Silicon Valley fundada por un cardiólogo, lanzó un video en febrero de 2016, mostrando su albóndiga de carne cultivada. En marzo de 2017, presentó ofertas de pollo y pato a la naranja, las primeras aves de corral cultivadas que se mostraron al público. Memphis Meats fue más tarde el tema del documental Meat the Future de 2020 .
Una empresa israelí, SuperMeat , realizó una campaña viral de financiación colectiva en 2016 por su trabajo en pollos cultivados.
Finless Foods, una empresa con sede en San Francisco destinada a peces de cultivo, se fundó en junio de 2016. En marzo de 2017 comenzó sus operaciones de laboratorio. El director Mike Selden dijo en julio de 2017 que esperaba que los productos pesqueros cultivados estuvieran en el mercado para fines de 2019.
En marzo de 2018, Eat Just (fundada en 2011 como Hampton Creek en San Francisco, más tarde conocida como Just, Inc.) afirmó poder ofrecer un producto de consumo a partir de carne cultivada para fines de 2018. Según el CEO Josh Tetrick, la tecnología ya estaba allí. JUST tenía alrededor de 130 empleados y un departamento de investigación de 55 científicos, donde se investigó la carne de laboratorio de aves, cerdo y res. JUST fue patrocinado por el multimillonario chino Li Ka-shing , Yahoo! el cofundador Jerry Yang y, según Tetrick, también de Heineken International y otros.
Hay un puñado [de empresas emergentes]. Es bastante interesante de ver, hay tres centros: uno en Silicon Valley , uno en los Países Bajos y otro en Israel. Creo que eso se debe a que estos tres lugares tienen, en primer lugar, una gran universidad agrícola: tenemos a Wageningen ; en segundo lugar, una gran universidad médica; para nosotros, esa es Leiden ; y finalmente tenemos a Delft en el lado de la ingeniería. Esos tres combinados le dan una base firme para [desarrollar carne cultivada], y esa [combinación] existe en Israel, los Países Bajos y Estados Unidos.
- Krijn de Nood, Meatable (2020)
La startup holandesa Meatable, que consta de Krijn de Nood, Daan Luining, Ruud Out, Roger Pederson, Mark Kotter y Gordana Apic, entre otros, informó en septiembre de 2018 que había logrado cultivar carne utilizando células madre pluripotentes de cordones umbilicales de animales . Aunque, según se informa, es difícil trabajar con estas células, Meatable afirmó ser capaz de dirigirlas para que se comporten para convertirse en células musculares o grasas según sea necesario. La principal ventaja es que esta técnica evita el suero bovino fetal , lo que significa que no es necesario sacrificar ningún animal para producir carne. Ese mes, se estima que 30 nuevas empresas de carne cultivada operaron en todo el mundo.
Integriculture es una empresa con sede en Japón que trabaja en su sistema CulNet. Los competidores incluyeron Multus Media con sede en Inglaterra y Canadian Future Fields.
En agosto de 2019, cinco startups anunciaron la formación de Alliance for Meat, Poultry & Seafood Innovation (AMPS Innovation), una coalición que busca trabajar con los reguladores para crear un camino hacia el mercado de carnes y mariscos cultivados. Los miembros fundadores incluyen Eat Just , Memphis Meats , Finless Foods, BlueNalu y Fork & Goode.
En 2019, el proyecto Foieture se lanzó en Bélgica con el objetivo de desarrollar foie gras cultivado (el nombre es una combinación de 'foie' y 'futuro') por un consorcio de 3 empresas (startup de carne cultivada Peace of Meat, small meat - condimento empresa Solina, y la pequeña paté empresa -producir Nauta) y 3 institutos sin ánimo de lucro (Universidad Universidad Católica de Lovaina , la industria alimentaria centro de innovación Flandes alimentos y Bio Planta piloto Base Europa). Peace of Meat declaró en diciembre de 2019 que tenía la intención de completar su prueba de concepto en 2020, producir su primer prototipo en 2022 y salir al mercado en 2023. Ese mes, el proyecto Foieture recibió una subvención de investigación de casi 3,6 millones de euros. de la Agencia de Innovación y Empresa del Gobierno de Flandes . En mayo de 2020, la cofundadora e investigadora científica austriaca de Peace of Meat, Eva Sommer, declaró que la startup pudo producir 20 gramos de grasa cultivada a un costo de unos 300 euros (15.000 € / kg); el objetivo era reducir el precio a 6 euros el kilo para 2030. Piece of Meat construyó dos laboratorios en el puerto de Amberes .
En 2019, Aleph Farm colaboró con 3D Bioprinting Solutions para cultivar carne en la Estación Espacial Internacional . Esto se hizo extruyendo células de carne en un andamio usando una impresora 3D.
En enero de 2020, Quartz encontró alrededor de 30 nuevas empresas de carne cultivada, y Memphis Meats, Just Inc. y Future Meat Technologies fueron las más avanzadas porque estaban construyendo plantas piloto. Según New Scientist en mayo de 2020, 60 empresas emergentes estaban desarrollando carne cultivada. Algunos de ellos eran proveedores de tecnología. Según los informes, los medios de cultivo todavía cuestan "cientos de dólares por litro, pero para que la producción de carne limpia aumente, esto debe bajar a alrededor de $ 1 por litro". En junio de 2020, los funcionarios del gobierno chino pidieron una estrategia nacional para competir en carne cultivada.
Entrada al mercado
En la Unión Europea , los alimentos nuevos , como los productos cárnicos cultivados, deben pasar por un período de prueba de aproximadamente 18 meses durante el cual una empresa debe demostrar a la Autoridad Europea de Seguridad Alimentaria (EFSA) que su producto es seguro.
El 2 de diciembre de 2020, la Agencia de Alimentos de Singapur aprobó las "picaduras de pollo" producidas por Eat Just para la venta comercial. Fue la primera vez que un producto de carne cultivada pasó la revisión de seguridad (que tomó 2 años) de un regulador de alimentos y fue ampliamente considerado como un hito para la industria. Se programó la introducción de los trozos de pollo en los restaurantes de Singapur.
Compañías
Nota: las fechas en cursiva se refieren a fechas proyectadas de logros en el futuro; pueden cambiar.
| Nombre | Fundado | Zona | Atención | Costos recientes | Prototipo | Planta piloto | Entrada al mercado |
|---|---|---|---|---|---|---|---|
| Granjas de Aleph | 2017 |
|
Carne de res | Más de $ 3,000 / kg (reclamo de noviembre de 2019) | Dic 2018 | Planeado para 2021 (reclamo de abril de 2020) | 2023 (reclamación de noviembre de 2019) |
| Las hormigas innovan | 2020 |
|
Cerdo | ||||
| Carnes Appleton | 2016 |
|
Carne de res | ||||
| Alimentos Artemys | 2019 |
|
Carne | Otoño 2020 | |||
| Carnes Avant | 2018 |
|
Proteína de pescado | Noviembre de 2019 | 2022 (reclamación de agosto de 2020) | ||
| Porque, animales | 2018 |
|
Alimentos para mascotas | Mayo de 2019 | |||
| Biftek | 2018 |
|
Medios culturales | ||||
| BioBQ | 2018 |
|
Andamio | 2022 | |||
| BlueNalu | 2018 |
|
Mariscos | Otoño 2019 | |||
| Alimentos BioTech | 2017 |
|
Cerdo | 100 € / kg (reclamación de julio de 2019) | 2021 (reclamación de julio de 2019) | ||
| Cell Ag Tech | 2018 |
|
Carne | ||||
| Tecnología de alimentos de Cell Farm | 2018 |
|
Carne | ||||
| CellX | 2020 |
|
Cerdo | 2021 | (para 2025) con el objetivo de lograr la paridad de costos con la carne de cerdo de origen convencional | ||
| Alimentos Cubiq | 2018 |
|
gordo | Sep. De 2019 | |||
| Comer solo | 2011 |
|
Carne | C. 50 € / pepita (reclamación de enero de 2020) | Dic. De 2017 | Construyendo desde mediados de 2019 (reclamo de enero de 2020) | Diciembre 2020 (restaurantes) |
| Alimentos sin aletas | 2016 |
|
Pez | $ 7,000 / lb (reclamo de febrero de 2018) | Sep. De 2017 | ||
| Proyecto Foieture (6 empresas / organizaciones sin ánimo de lucro) |
2019 |
|
Foie gras | 15.000 € / kg (reclamación de mayo de 2020) | 2020 (reclamación de diciembre de 2019) | 2022 (reclamación de diciembre de 2019) | 2023 (reclamación de diciembre de 2019) |
| Horquilla y Goode | 2018 |
|
Carne | ||||
| Campos futuros | 2017 |
|
Medios culturales | ||||
| Tecnologías cárnicas futuras | 2018 |
|
Carne | $ 10 / lb (meta de febrero de 2020 para 2022) | 2019 | Construyendo desde Oct 2019 | 2022 (reclamación de octubre de 2019) |
| Alimentos Gaia | 2019 |
|
carne roja | ||||
| Gourmey | 2019 |
|
Foie gras | ||||
| Heuros | 2017 |
|
Alimentos para mascotas | ||||
| Filetes más altos | 2017 |
|
Cerdo | £ 'Miles' / kg (reclamación de julio de 2020) | Julio de 2020 | ||
| IntegriCulture, Inc. | 2015 |
|
Foie gras | 20.000 yenes / kg (reclamación de julio de 2019) | 2021 | 2021 (reclamación de julio de 2020) | |
| Carnes Matrix | 2019 |
|
Andamio | 2020 | |||
| Comestible | 2018 |
|
Cerdo | 2020 (reclamación de enero de 2020) | Planeado para principios de 2022 (reclamo de febrero de 2020) | 2022 (reclamación de enero de 2020) | |
| Upside Foods (anteriormente Memphis Meats) | 2015 |
|
Aves de corral | $ 1,700 / lb (reclamo de febrero de 2018) | Febrero de 2016 | Construyendo desde enero de 2020 | Alrededor de 2020 (reclamación de febrero de 2017) |
| Alimentos Mirai | 2020 |
|
Carne de res | 'Coche pequeño' / kg (reclamación de junio de 2020) | Junio de 2020 | ||
|
Carne Mosa / Universidad de Maastricht |
2015 |
|
Carne de res |
60 € / kg (objetivo de febrero de 2017 para 2020) '88 veces más barato' (reclamación de julio de 2020) |
Agosto de 2013 ( MU ) | Instalación desde mayo de 2020 | 2022 (reclamación de febrero de 2020) |
| Motif FoodWorks | 2019 |
|
Carne de res | Finales de 2020 (reclamación de agosto de 2020) | Q4 2021 (saborizante de carne) (reclamo de octubre de 2020) | ||
| Multus Media | 2019 |
|
Medios culturales | Octubre de 2019 | |||
| Carnes New Age | 2018 |
|
Cerdo | Sep. De 2018 | Construyendo después de julio de 2020 | ||
| Saborear | 2016 |
|
Carne de res | Mediados de 2021 (restaurantes) (reclamación de mayo de 2020) | |||
| Carnes Shiok | 2018 |
|
Camarón | $ 3,500 / kg (reclamación de octubre de 2020) | 2019 | 2021 (reclamación de marzo de 2020) | |
| Supercarne | 2015 |
|
Aves de corral | 2018 | Para 2022 (reclamación de mayo de 2020) | ||
| Alimentos VOW | 2019 |
|
Canguro | US $ 1350 / kg (reclamación de agosto de 2019) | Ago. De 2019 | 2021 (restaurantes) (reclamo de octubre de 2019) | |
| Tipo salvaje | 2016 |
|
Mariscos |
Aparte de estas empresas, organizaciones sin fines de lucro como New Harvest , Good Food Institute y Cellular Agriculture Society abogan por, financian e investigan la carne cultivada.
Proceso
Líneas celulares
La agricultura celular requiere líneas celulares, generalmente células madre. Las células madre son células indiferenciadas que tienen el potencial de convertirse en muchos o todos los tipos requeridos de tipos de células especializadas. Las células madre totipotentes tienen la capacidad de diferenciarse en todos los diferentes tipos de células que se encuentran dentro del cuerpo. Las células madre pluripotentes pueden madurar en todos los tipos de células excepto las de la placenta, y las células madre multipotentes pueden diferenciarse en varias células especializadas dentro de un linaje. Las células madre unipotentes pueden diferenciarse en un destino celular específico.
Si bien las células madre pluripotentes serían una fuente ideal, el ejemplo más destacado de esta subcategoría son las células madre embrionarias que, debido a cuestiones éticas, son controvertidas para su uso en investigación. Como resultado, los científicos han desarrollado células madre pluripotentes inducidas (iPSC), esencialmente células sanguíneas y cutáneas multipotentes que han retrocedido a un estado pluripotente que les permite diferenciarse en una mayor variedad de células. La alternativa es utilizar células madre adultas multipotentes que dan lugar a linajes de células musculares o progenitores unipotentes que se diferencian en células musculares.
Las características favorables de las células madre incluyen la inmortalidad, la capacidad proliferativa, la falta de dependencia de la adherencia, la independencia del suero y la fácil diferenciación en tejido. Sin embargo, es probable que la presencia natural de tales características difiera según la especie y el origen de las células. Como tal, el cultivo in vitro debe ajustarse para satisfacer las necesidades exactas de una línea celular específica. Con respecto a la inmortalidad, las células tienen un límite en la cantidad de veces que pueden dividirse, que está dictado por su capa de telómeros : bases de nucleótidos suplementarios que se agregan al final de sus cromosomas. Con cada división, la capa de los telómeros se acorta progresivamente hasta que no queda nada, en cuyo caso la célula deja de dividirse. Al inducir la pluripotencia, la capa de los telómeros se puede alargar de manera que la célula se divida indefinidamente. Las células de insecto utilizadas en el entomocultivo no dependen naturalmente de los medios de cultivo basados en suero ni de la adherencia y, por lo tanto, pueden cultivarse más densamente en cultivos en suspensión en comparación con las células de mamíferos.
Las líneas celulares se pueden recolectar de una fuente primaria, es decir, a través de una biopsia en un animal bajo anestesia local. También podrían establecerse a partir de fuentes secundarias como cultivos crioconservados (cultivos congelados después de investigaciones previas).
Medio de crecimiento
Una vez que se establecen las líneas celulares, se sumergen en un medio de cultivo para inducir su proliferación. Los medios de cultivo se formulan típicamente a partir de medios basales que proporcionan a las células los carbohidratos, grasas, proteínas y sales necesarios. Una vez que una célula consume una cantidad suficiente, se divide y la población aumenta exponencialmente. Los medios de cultivo se pueden complementar con aditivos, por ejemplo sueros, que aportan factores de crecimiento adicionales. Los factores de crecimiento pueden ser proteínas secretadas o esteroides que son cruciales para regular los procesos celulares. Normalmente, los factores de crecimiento se añaden al medio de cultivo mediante la integración de suero bovino fetal (FBS) u otro suero de origen animal o mediante la producción de proteínas recombinantes.
Una vez que comienza la diferenciación, las fibras musculares comienzan a contraerse y a generar ácido láctico. La capacidad de las células para absorber nutrientes y proliferar depende en parte del pH de su entorno. A medida que el ácido láctico se acumula dentro del medio, el ambiente se volverá progresivamente más ácido y caerá por debajo del pH óptimo. Como resultado, los medios de cultivo deben actualizarse con frecuencia. Esto ayuda a refrescar la concentración de nutrientes del medio basal.
Andamio
En el caso de productos cárnicos estructurados, productos que se caracterizan por su configuración general y por su tipo de celda, las celdas deben sembrarse en andamios. Los andamios son esencialmente moldes destinados a reflejar y alentar a las células a organizarse en una estructura más grande. Cuando las células se desarrollan in vivo , están influenciadas por sus interacciones con la matriz extracelular (MEC). El ECM es la malla tridimensional de glicoproteínas , colágeno y enzimas responsables de transmitir señales mecánicas y bioquímicas a la célula. Los andamios deben simular las características del ECM. Propiedades clave:
Porosidad
Los poros son pequeñas aberturas en la superficie del andamio. Se pueden crear en la superficie del biomaterial para liberar componentes celulares que podrían interferir con el desarrollo de los tejidos. También ayudan a difundir el gas y los nutrientes a las capas más internas de las células adherentes, lo que evita el desarrollo de un "centro necrótico" (creado cuando las células que no están en contacto directo con el medio de cultivo mueren debido a la falta de nutrientes).
Vascularización
El tejido vascular que se encuentra en las plantas contiene los órganos responsables del transporte interno de fluidos. Forma topografías naturales que proporcionan una forma de bajo costo para promover la alineación celular al replicar el estado fisiológico natural de los mioblastos. También puede ayudar con el intercambio de gases y nutrientes.
Propiedades bioquimicas
Las propiedades bioquímicas de un andamio deben ser similares a las del ECM. Debe facilitar la adhesión celular a través de cualidades de textura o enlaces químicos. Además, debe producir las señales químicas que fomenten la diferenciación celular. Alternativamente, el material debería poder mezclarse con otras sustancias que tengan estas cualidades funcionales.
Cristalinidad
El grado de cristalinidad de un material determina cualidades como la rigidez. La alta cristalinidad se puede atribuir al enlace de hidrógeno que a su vez aumenta la estabilidad térmica, la resistencia a la tracción (importante para mantener la forma del andamio), la retención de agua (importante para hidratar las células) y el módulo de Young .
Degradación
Ciertos materiales se degradan en compuestos que son beneficiosos para las células, aunque esta degradación también puede ser irrelevante o perjudicial. La degradación permite quitar fácilmente el andamio del producto terminado dejando solo tejido animal, aumentando así su parecido con la carne in vivo . Esta degradación puede ser inducida por la exposición a ciertas enzimas que no impactan en el tejido muscular.
Comestibilidad
Si los andamios no se pueden quitar del tejido animal, deben ser comestibles para garantizar la seguridad del consumidor. Sería beneficioso si estuvieran hechos de ingredientes nutritivos.
Desde 2010, han surgido grupos de investigación académica y empresas con el fin de identificar materias primas que tengan las características de andamios adecuados.
Celulosa
La celulosa es el polímero más abundante en la naturaleza y proporciona los exoesqueletos de las hojas de las plantas. Debido a su abundancia, se puede obtener a un costo relativamente bajo. También es versátil y biocompatible. A través de un proceso llamado "descelularización", se recubre con un surfactante que crea poros. Estos poros liberan los componentes celulares de la planta y se convierte en tejido vegetal descelularizado. Este material ha sido ampliamente estudiado por los Grupos Pelling y Gaudette de la Universidad de Ottawa y el Instituto Politécnico de Worcester , respectivamente. A través de la reticulación (formando enlaces covalentes entre cadenas de polímeros individuales para mantenerlas juntas), las propiedades mecánicas del tejido vegetal se pueden cambiar para que se parezca más al tejido muscular. Esto también se puede hacer mezclando tejido vegetal con otros materiales. Por otro lado, el tejido vegetal descelularizado generalmente carece de señales bioquímicas de mamíferos, por lo que debe estar recubierto con proteínas funcionales compensatorias. No se demostró que el crecimiento de C2C12 cambiara significativamente entre el armazón desnudo y el mismo armazón con un recubrimiento de proteínas de colágeno o gelatina , sin embargo, la eficiencia de la siembra (velocidad a la que las células se unen al armazón) mejoró. Una ventaja del tejido vegetal descelularizado es la topografía natural que ofrece la vasculatura foliar. Esto ayuda a replicar el estado fisiológico natural de los mioblastos que promueve la alineación celular. Las otras formas de hacer esto suelen ser un poco más caras, incluida la impresión 3D, la litografía suave y la fotolitografía. La vascularización también puede ayudar a superar el límite de difusión de 100 a 200 nm del medio de cultivo hacia las células que suelen producir centros necróticos en los conglomerados musculares. Otra forma de hacer esto es tener un andamio poroso que apoye la angiogénesis (el desarrollo de nuevos vasos sanguíneos). Si bien se ha demostrado que esto funciona para Apple Hypanthium , no todas las plantas son tan porosas. La alternativa a la celulosa vegetal es la celulosa bacteriana, que normalmente es más pura que la celulosa vegetal, ya que está libre de contaminantes como la lignina y la hemicelulosa . La celulosa bacteriana tiene más enlaces de hidrógeno entre sus hebras de polímero y, por lo tanto, tiene una mayor cristalinidad. También tiene microfibrillas más pequeñas que le permiten retener más humedad y tener poros más pequeños. La sustancia se puede producir utilizando carbohidratos de desecho (lo que puede permitir que se produzca a menor costo) y agrega jugosidad y masticabilidad a la carne emulsionada (lo que significaría que incluso si no se puede sacar del producto final, contribuirá al perfil de textura).
Quitina
La quitina es el segundo polímero más abundante de la naturaleza. Se encuentra en los exoesqueletos de crustáceos y hongos . Dado que la agricultura celular está intentando acabar con la dependencia de los animales, la quitina derivada de hongos es de mayor interés. En su mayoría, ha sido estudiado por Pelling Group. El quitosano se deriva de la quitina en un proceso conocido como desacetilación alcalina (sustituyendo ciertos grupos de aminoácidos ). El grado de este proceso determina las propiedades físicas y químicas del quitosano. El quitosano tiene propiedades antibacterianas; en particular, tiene efectos bactericidas sobre bacterias planctónicas y biopelículas y efectos estáticos de bacterias sobre bacterias gramnegativas como E. coli . Esto es importante ya que neutraliza compuestos potencialmente dañinos sin usar antibióticos , que muchos consumidores evitan. La semejanza del quitosano con los glicosaminoglicanos y las interacciones internas entre las glicoproteínas y los proteoglicanos lo hacen altamente biocompatible. Puede mezclarse fácilmente con otros polímeros para seleccionar factores más bioactivos. Una posible desventaja del quitosano es que se degrada en presencia de lisozimas (enzimas naturales). Pero, esto se puede resistir usando desacetilación . Esto no es del todo negativo, ya que los subproductos producidos a través de la degradación tienen propiedades antiinflamatorias y antibacterianas. Es importante igualar el nivel en el que las células dependen de la matriz para estructurar la degradación.
Colágeno
El colágeno es una familia de proteínas que constituye la estructura primaria del tejido conectivo humano. Normalmente se deriva de fuentes bovinas, porcinas y murinas . La agricultura celular supera esta dependencia mediante el uso de organismos transgénicos que son capaces de producir las repeticiones de aminoácidos que componen el colágeno. El colágeno existe naturalmente como colágeno tipo I. Se ha producido como hidrogeles porosos, compuestos y sustratos con señales topográficas y propiedades bioquímicas. Se han producido tipos sintéticos de colágeno mediante la producción de proteínas recombinantes: colágeno de tipo II y III, tropoelastina y fibronectina . Un desafío con estas proteínas es que no se pueden modificar después de la traducción. Sin embargo, se ha aislado una proteína fibrilar alternativa en microbios que carecen de las señales bioquímicas del colágeno, pero que tienen su tipo de personalización genética. Un enfoque de la producción de colágeno recombinante es la optimización del rendimiento: cómo se puede producir de manera más eficaz. Las plantas, en particular el tabaco, parecen la mejor opción, sin embargo, las bacterias y las levaduras también son alternativas viables.
La proteína de soja texturizada es un producto de harina de soya que se usa a menudo en la carne de origen vegetal y que favorece el crecimiento de las células bovinas. Su textura esponjosa permite una siembra celular eficiente y su porosidad favorece la transferencia de oxígeno. Además, se degrada durante la diferenciación celular en compuestos que son beneficiosos para ciertas células.
Micelio
El micelio son las raíces de los hongos. Altast Foods Co.está utilizando fermentación en estado sólido para hacer crecer tejido de hongos en andamios de micelio. Recogen este tejido y lo utilizan para crear análogos de tocino.
Nanomateriales
Los nanomateriales exhiben propiedades únicas a nanoescala . Biomimetic Solutions, con sede en Londres, está aprovechando los nanomateriales para crear andamios.
Cass Materials en Perth, Australia, está utilizando una fibra dietética llamada Nata de Coco (derivada de los cocos) para crear esponjas de nanocelulosa para su andamio BNC. Nata de Coco es biocompatible, tiene una alta porosidad, facilita la adhesión celular y es biodegradable.
Hilado
Immersion Jet Spinning es un método para crear andamios hilando polímeros en fibras. Fue desarrollado por Parker Group en Harvard. Su plataforma utiliza fuerza centrífuga para extruir una solución de polímero a través de una abertura en un depósito giratorio. Durante la extrusión, la solución forma un chorro que se alarga y se alinea a medida que cruza el espacio de aire. El chorro se dirige a un baño de precipitación controlado por vórtice que químicamente entrecruza o precipita nanofibras poliméricas. El ajuste del entrehierro, la rotación y la solución cambia el diámetro de las fibras resultantes. Este método puede hacer girar andamios de láminas de PPTA, nailon, ADN y nanofibras. Un andamio nanofibroso hecho de alginato y gelatina pudo soportar el crecimiento de las células C2C12. Los mioblastos de músculo liso aórtico de conejo y bovino pudieron adherirse a las fibras de gelatina. Formaron agregados en fibras más cortas y alinearon tejido en las más largas.
Matrix Meats utiliza electrohilado , un proceso que utiliza fuerza eléctrica para convertir polímeros cargados en fibras para andamios. Sus andamios permitían el veteado de la carne, son compatibles con múltiples líneas celulares y son escalables.
Fabricación aditiva
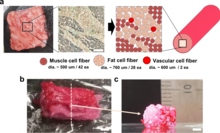
Otra forma propuesta de estructurar el tejido muscular es la fabricación aditiva . Esta técnica se perfeccionó para aplicaciones industriales en la fabricación de objetos hechos de plástico, nailon, metal, vidrio y otros materiales sintéticos. La variación más común del proceso consiste en depositar gradualmente un filamento en capas sobre un lecho hasta que se completa el objeto. Es muy probable que este método se preste mejor a la aplicación de carne cultivada en comparación con otros tipos, como el chorro de aglutinante, el chorro de material o la estereolitografía que requieren un tipo específico de resina o polvo.
Un filamento de células musculares se puede imprimir en una estructura que se asemeja a un producto cárnico terminado que luego se puede procesar para la maduración celular. Esta técnica se ha demostrado en una colaboración entre las soluciones de bioimpresión 3D y Aleph Farms que utilizó la fabricación aditiva para estructurar las células de pavo en la Estación Espacial Internacional.
La bioimpresión 3D se ha utilizado para producir carne cultivada similar a un filete, compuesta por tres tipos de fibras de células bovinas y con una estructura de fibras celulares ensambladas que es similar a la carne original.
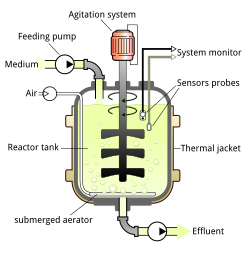
Biorreactores
Los andamios se colocan dentro de los biorreactores para que pueda ocurrir el crecimiento y la especialización celular. Los biorreactores son máquinas grandes similares a los tanques de las cervecerías que exponen las células a una gran variedad de factores ambientales que son necesarios para promover la proliferación o la diferenciación. La temperatura del biorreactor debe reproducir las condiciones in vivo . En el caso de las células de los mamíferos, esto requiere un calentamiento a 37 grados centígrados. Alternativamente, las células de insectos se pueden cultivar a temperatura ambiente. La mayoría de los biorreactores se mantienen al 5% de dióxido de carbono.
Las células pueden cultivarse en sistemas continuos o por lotes alimentados. El primero implica inocular y recolectar células en un proceso constante para que siempre haya células en el biorreactor. Los sistemas de alimentación por lotes significan inocular las células, cultivarlas y cosecharlas en un solo período.
Los biorreactores de tanque agitado son la configuración más utilizada. Un impulsor aumenta el flujo, homogeneizando así el medio de cultivo y un difusor facilita el intercambio de oxígeno en el medio. Este sistema se usa generalmente para cultivos suspendidos, pero puede usarse para células que requieren fijación a otra superficie si se incluyen microportadores. Los biorreactores de lecho fijo se utilizan comúnmente para cultivos adherentes. Cuentan con tiras de fibras que se empaquetan juntas para formar un lecho al que las células pueden adherirse. El medio de cultivo aireado se hace circular a través del lecho. En los biorreactores de transporte aéreo, el medio de cultivo se airea en forma gaseosa utilizando burbujas de aire que luego se esparcen y se dispersan entre las células. Los biorreactores de perfusión son configuraciones comunes para el cultivo continuo. Drenan continuamente los medios saturados con ácido láctico que carecen de nutrientes y los llenan con medios reabastecidos.
Fermentación
Los elementos descritos anteriormente se aplican al cultivo de tejido muscular animal. Sin embargo, la agricultura celular incluye la "agricultura acelular", que implica la producción de productos animales sintetizados de material no vivo. Dichos productos incluyen leche, miel, huevos, queso y gelatina, que están hechos de varias proteínas en lugar de células. En tales casos, estas proteínas deben fermentarse al igual que en la producción de proteínas recombinantes, la elaboración de alcohol y la generación de muchos productos de origen vegetal como el tofu, el tempeh y el chucrut.
Las proteínas están codificadas por genes específicos, los genes que codifican la proteína de interés se sintetizan en un plásmido , un circuito cerrado de información genética de doble hélice. Este plásmido, llamado ADN recombinante , se inserta luego en una muestra bacteriana. Para que esto suceda, la bacteria debe ser competente (es decir, capaz de aceptar ADN extracelular extraño) y capaz de transferir genes de forma horizontal (es decir, integrar los genes extraños en su propio ADN). La transferencia horizontal de genes es significativamente más desafiante en organismos eucariotas que en organismos procariotas porque los primeros tienen una membrana celular y una membrana nuclear que el plásmido necesita para penetrar, mientras que los organismos procariotas solo tienen una membrana celular. Por esta razón, a menudo se favorecen las bacterias procariotas. Para hacer que una bacteria de este tipo sea temporalmente competente, puede exponerse a una sal como el cloruro de calcio , que neutraliza las cargas negativas en las cabezas de fosfato de la membrana celular, así como las cargas negativas en el plásmido para evitar que las dos se repelan. Las bacterias pueden incubarse en agua tibia, abriendo grandes poros en la superficie celular a través de los cuales puede entrar el plásmido.
A continuación, la bacteria se fermenta en azúcar, lo que la estimula a crecer y duplicarse. En el proceso, expresa su ADN y el plásmido transferido que da como resultado la proteína.
Finalmente, la solución se purifica para separar la proteína residual. Esto se puede hacer introduciendo un anticuerpo generado contra la proteína de interés que matará las células bacterianas que no contienen la proteína. Mediante centrifugación, la solución se puede girar alrededor de un eje con fuerza suficiente para separar los sólidos de los líquidos. Alternativamente, podría empaparse en una solución iónica tamponada que emplea ósmosis para lixiviar el agua de las bacterias y matarlas.
Desafíos
Factores de crecimiento
El medio de cultivo es un componente esencial del cultivo in vitro . Se encarga de aportar las macromoléculas, nutrientes y factores de crecimiento necesarios para la proliferación celular. La obtención de factores de crecimiento es una de las tareas más desafiantes de la agricultura celular. Tradicionalmente, implica el uso de suero bovino fetal (FBS), que es un producto sanguíneo extraído de vacas fetales. Además del argumento de que su producción no es ética, también vicia la independencia del uso de animales. También es el componente más costoso de la carne cultivada, con un precio de alrededor de $ 1000 por litro. Además, la composición química varía mucho según el animal, por lo que no se puede cuantificar químicamente de manera uniforme. Se emplea FBS porque imita convenientemente el proceso de desarrollo muscular in vivo . Los factores de crecimiento necesarios para el desarrollo de los tejidos se proporcionan predominantemente a través del torrente sanguíneo de un animal, y ningún otro fluido conocido puede administrar todos estos componentes por sí solo.
La alternativa actual es generar cada factor de crecimiento individualmente utilizando la producción de proteínas recombinantes. En este proceso, los genes que codifican el factor específico se integran en bacterias que luego se fermentan. Sin embargo, debido a la complejidad adicional de este proceso, es particularmente caro.
El medio ideal sería cuantificable químicamente y accesible para garantizar simplicidad en la producción, barato y no dependiente de animales. Lo más probable es que se derive de plantas y, si bien esto puede reducir la posibilidad de transmitir agentes infecciosos, puede inducir reacciones alérgicas en algunos consumidores. Dichos sueros de cultivo también pueden requerir modificaciones específicas de la línea celular a la que se aplica. Las empresas que actualmente invierten en el desarrollo de cultivos efectivos basados en plantas incluyen Future Fields, Multus Media y Biftek.
El Good Food Institute (GFI) publicó un informe en 2019 en apoyo del concepto de que la carne a base de células podría producirse al mismo costo que la carne molida y en 2021 encargó un informe a CE Delft sobre el análisis tecnoeconómico de carne cultivada. Si bien llegaron a la conclusión de que los costos actuales de producción de sustitutos de proteínas cultivadas en el orden de 100 a 10,000 veces más que los productos cárnicos tradicionales, predijeron que las futuras mejoras técnicas darían lugar a reducciones sustanciales de costos. El optimismo de que los costos de producción de proteínas basadas en células se pueden reducir en más de 1000 veces es poco realista dado que después de decenas de miles de millones de dólares de inversión por parte de las industrias farmacéutica y afines durante los últimos 15 a 20 años, la productividad de los medicamentos basados en células. solo se ha mejorado de 10 a 20 veces. Los costos actuales de producción de carne a base de células, dada la información proporcionada, se estiman en $ 8.500 a $ 36.000 (± 30%) por kilogramo. Esta estimación no incluye costos precisos para agregar componentes nutricionales, necesidad total de energía por kg de producto, procesamiento a un formato comestible, costos de empaque o almacenamiento, ya que estos no han sido definidos.
Área de superficie
Un desafío común para los biorreactores y los andamios es el desarrollo de configuraciones de sistemas que permitan que todas las células se expongan a los medios de cultivo y, al mismo tiempo, optimicen los requisitos espaciales. En la fase de proliferación celular, antes de la introducción del armazón, es necesario unir muchos tipos de células a una superficie para apoyar el crecimiento. Como tal, las células deben cultivarse en monocapas confluentes de solo una célula de espesor, lo que requiere una gran superficie. Esto plantea desafíos prácticos a gran escala. Como tal, los sistemas pueden incorporar microportadores: pequeñas perlas esféricas de vidrio u otro material compatible que se suspenden en el medio de cultivo. Las células se adhieren a estos microportadores como lo harían con los lados del biorreactor, lo que aumenta la cantidad de área de superficie.
En la fase de diferenciación celular, las células se pueden sembrar en un andamio y, por lo tanto, no requieren el uso de microportadores. Sin embargo, en estos casos, la densidad de las células en el andamio significa que no todas las células tienen una interfaz con los medios de cultivo, lo que conduce a la muerte celular y a los centros necróticos dentro de la carne. Cuando el músculo se cultiva in vivo , este problema se evita ya que el ECM suministra nutrientes al músculo a través de los vasos sanguíneos. Como tal, muchos andamios emergentes tienen como objetivo replicar tales redes.
De manera similar, los andamios deben simular muchas de las otras características del ECM, más notablemente la porosidad, cristalinidad, degradación, biocompatibilidad y funcionalidad. Se han identificado pocos materiales que emulen todas estas características, dando lugar a la posibilidad de mezclar diferentes materiales con propiedades complementarias.
Apoyo a la investigación
La investigación en agricultura celular no tiene una base significativa de interés académico o fuentes de financiamiento. En consecuencia, la mayor parte de la investigación ha sido realizada y financiada por instituciones independientes. Sin embargo, esto está cambiando gradualmente, ya que el apoyo y el interés no impulsados por las ganancias. En particular, New Harvest tiene un programa de becas para apoyar a estudiantes y grupos graduados en varias instituciones académicas.
Aceptación del consumidor
La aceptación del producto por parte del consumidor es fundamental. Un estudio que analizó la aceptación de la carne cultivada en China, India y EE. UU. "Encontró altos niveles de aceptación de la carne limpia en los tres países más poblados del mundo".
Se han identificado varios factores potenciales de aceptación de la carne cultivada por parte de los consumidores. La salubridad, la seguridad, las características nutricionales, la sostenibilidad, el sabor y el precio más bajo son factores que contribuyen. Un estudio encontró que el uso de un lenguaje altamente técnico para explicar la carne cultivada condujo a una actitud pública significativamente más negativa hacia el concepto. Comunicar la ciencia de manera transparente es importante, pero compartir en exceso los aspectos incorrectos del producto podría atraer una atención desfavorable a los problemas de seguridad. Por lo tanto, uno de los desafíos en la forma en que se comercializa la carne cultivada es lograr el equilibrio entre la transparencia de la ciencia detrás de ella, pero comunicarla de una manera que no evoque resistencias. Un estudio sugirió que describir la carne cultivada de una manera que enfatice el producto final en lugar del método de producción era una forma eficaz de mejorar la aceptación. El papel de la nomenclatura también es crucial. Aunque el sensacionalismo de los medios de comunicación favorece la representación de la carne cultivada en el laboratorio , los líderes de la industria se han opuesto a ella, ya que siembra una imagen innatamente antinatural de la carne cultivada en las percepciones de los consumidores.
El uso de descripciones estandarizadas mejoraría la investigación futura sobre la aceptación de la carne cultivada por parte de los consumidores. Los estudios actuales a menudo han informado tasas de aceptación drásticamente diferentes, a pesar de que las poblaciones de encuestas son similares. Lou Cooperhouse, director ejecutivo de BlueNalu, compartió en el podcast Red to Green que "basado en células" y "cultivado en células" eran términos adecuados para diferenciarla de la carne convencional y, al mismo tiempo, ser claro sobre el proceso mediante el cual se hizo.
No se ha evaluado la aceptación del mercado mundial. Los estudios están intentando determinar los niveles actuales de aceptación del consumidor e identificar métodos para mejorar este valor. No se dispone de respuestas claras, aunque un estudio reciente informó que los consumidores estaban dispuestos a pagar una prima por la carne cultivada.
Se ha informado que bajos porcentajes de poblaciones de adultos mayores muestran aceptación de la carne cultivada. El comportamiento alimentario ecológico, el nivel educativo y el negocio alimentario fueron citados como los factores más importantes para esta población.
También faltan estudios que relacionen los métodos de producción de carne cultivada con su gusto para el público consumidor.
Normativas
También deben resolverse los asuntos regulatorios. Antes de estar disponible para la venta, la Unión Europea y Canadá exigen nuevas aplicaciones alimentarias aprobadas. Además, la Unión Europea exige que los productos y la producción de animales cultivados deben demostrar su seguridad, mediante una solicitud de empresa aprobada, a partir del 1 de enero de 2018.
Dentro de los Estados Unidos , la FDA ( Administración de Alimentos y Medicamentos) y el USDA (Departamento de Agricultura de los Estados Unidos) han acordado regular conjuntamente la carne cultivada. Según el acuerdo, la FDA supervisa la recolección de células, los bancos de células y el crecimiento y diferenciación celular, mientras que el USDA supervisa la producción y el etiquetado de productos alimenticios humanos derivados de las células.
Diferencias con la carne convencional.
Salud
La producción a gran escala de carne cultivada puede requerir o no la adición de hormonas de crecimiento artificiales al cultivo para la producción de carne.
Los investigadores han sugerido que los ácidos grasos omega-3 podrían agregarse a la carne cultivada como una ventaja para la salud. De manera similar, el contenido de ácidos grasos omega-3 de la carne convencional se puede aumentar alterando la alimentación de los animales. Un número de la revista Time sugirió que el proceso de cultivo celular también puede disminuir la exposición de la carne a bacterias y enfermedades.
Debido al entorno estrictamente controlado y predecible, la producción de carne cultivada se ha comparado con la agricultura vertical . Algunos de sus defensores han predicho que tendrá beneficios similares en términos de reducción de la exposición a químicos peligrosos como pesticidas y fungicidas, lesiones graves y vida silvestre.
También hay una falta de investigación sobre la comparación de los efectos en la salud de la producción de carne cultivada con la carne industrial o las formas de producción de carne orgánica biológica.
Lo artificial
Aunque la carne cultivada consiste en células de músculo animal, grasa y células de soporte, así como vasos sanguíneos, que son los mismos que en la carne tradicional, algunos consumidores pueden encontrar inaceptable el proceso de producción de alta tecnología. La carne cultivada se ha descrito como falsa o "Frankenmeat". Por otro lado, la carne limpia se puede producir sin las hormonas artificiales, antibióticos, esteroides, medicamentos y OGM que se usan comúnmente en la carne y mariscos de cría industrial, aunque no se usan en la producción biológica orgánica.
Si un producto cárnico cultivado es diferente en apariencia , sabor , olor , textura u otros factores, es posible que no sea comercialmente competitivo con la carne producida convencionalmente. La falta de sistema óseo y cardiovascular es una desventaja para los platos en los que estas partes hacen aportes culinarios apreciables. Sin embargo, la falta de huesos y / o sangre puede hacer que muchas preparaciones tradicionales de carne, como las alas de búfalo , sean más apetecibles para algunas personas. Además, la sangre y los huesos podrían potencialmente cultivarse en el futuro.
Medio ambiente
La producción animal para la alimentación es una de las principales causas de la contaminación del aire / agua y de las emisiones de carbono. Se han planteado importantes interrogantes sobre si la industria tradicional puede satisfacer la creciente demanda de carne. La carne cultivada puede proporcionar una alternativa respetuosa con el medio ambiente a la producción tradicional de carne.
Se espera que los impactos ambientales de la carne cultivada sean significativamente menores que los de la cría de animales. Por cada hectárea que se utiliza para la agricultura vertical y / o la fabricación de carne cultivada, entre 10 y 20 hectáreas de tierra pueden volver a su estado natural. Las granjas verticales (además de las instalaciones de cultivo de carne) podrían aprovechar los digestores de metano para generar una parte de sus necesidades eléctricas. Se podrían construir digestores de metano en el sitio para transformar los desechos orgánicos generados en la instalación en biogás, que generalmente está compuesto por un 65% de metano. Este biogás podría quemarse para generar electricidad para el invernadero o una serie de biorreactores.
Un estudio informó que la carne cultivada era "potencialmente ... mucho más eficiente y respetuosa con el medio ambiente". Generó solo el 4% de las emisiones de gases de efecto invernadero, redujo las necesidades energéticas de la producción de carne hasta en un 45% y requirió solo el 2% de la tierra que hace la industria mundial de la carne / ganado. En el análisis del ciclo de vida de Tuomisto se afirmó que producir 1000 kg de carne de manera convencional requiere "26-33 GJ de energía, 367-521 m³ de agua, 190-230 m² de tierra y emite 1900-2240 kg de CO2-eq de emisiones de GEI". Por otro lado, producir la misma cantidad de carne in vitro tiene "entre un 7% y un 45% menos de uso de energía ... un 78% a 96% menos de emisiones de GEI, un 99% menos de uso de la tierra y un 82% a 96% menos de agua".
La escéptica Margaret Mellon de la Unión de Científicos Preocupados especula que las necesidades de energía y combustibles fósiles de la producción de carne cultivada a gran escala pueden ser más destructivas para el medio ambiente que la producción de alimentos en la tierra. Sin embargo, SL Davis especuló que tanto la agricultura vertical en áreas urbanas como la actividad de las instalaciones de cultivo de carne pueden causar relativamente poco daño a la vida silvestre que vive alrededor de las instalaciones. Dickson Despommier especuló que los recursos naturales podrían salvarse del agotamiento debido a la agricultura vertical y la carne cultivada. Un estudio informó que la agricultura convencional mata diez animales salvajes por hectárea cada año.
Papel de la modificación genética
Las técnicas de ingeniería genética , como la inserción, deleción, silenciamiento, activación o mutación de un gen, no son necesarias para producir carne cultivada. La producción de carne cultivada permite que los procesos biológicos que ocurren normalmente dentro de un animal ocurran sin el animal. Dado que la carne cultivada se cultiva en un ambiente artificial controlado, algunos han comentado que la carne cultivada se parece más a los vegetales hidropónicos que a los vegetales modificados genéticamente .
Se están realizando más investigaciones sobre la carne cultivada y, aunque la carne cultivada no requiere ingeniería genética, los investigadores pueden emplear estas técnicas para mejorar la calidad y la sostenibilidad. La fortificación de la carne cultivada con nutrientes como los ácidos grasos beneficiosos es una mejora que puede facilitarse mediante la modificación genética. La misma mejora se puede realizar sin modificación genética, manipulando las condiciones del medio de cultivo. La modificación genética puede mejorar la proliferación de células musculares. La introducción de factores reguladores miogénicos, factores de crecimiento u otros productos génicos en las células musculares puede aumentar la producción con respecto a la de la carne convencional.
Para evitar el uso de cualquier producto animal, se ha propuesto el uso de algas fotosintéticas y cianobacterias para producir los ingredientes principales para los medios de cultivo, a diferencia del suero fetal bovino o equino. Algunos investigadores proponen que la capacidad de las algas y las cianobacterias para producir ingredientes para los medios de cultivo se puede mejorar con ciertas tecnologías, probablemente sin excluir la ingeniería genética.
Ético
El bioético australiano Julian Savulescu dijo: "La carne artificial detiene la crueldad hacia los animales, es mejor para el medio ambiente, podría ser más segura y eficiente, e incluso más saludable. Tenemos la obligación moral de apoyar este tipo de investigación. Obtiene el visto bueno ético . " Los grupos de bienestar animal generalmente están a favor de la carne cultivada, porque el proceso de cultivo no incluye un sistema nervioso y por lo tanto no implica dolor ni vulneración de derechos. Las reacciones de los vegetarianos a la carne cultivada varían. Algunos sienten que la carne cultivada presentada al público en agosto de 2013 no era vegetariana porque se usó suero bovino fetal en el medio de crecimiento. Sin embargo, desde entonces, la carne cultivada se ha cultivado en un medio que no incluye suero bovino. El filósofo Carlo Alvaro sostiene que la cuestión de la moralidad de comer carne in vitro se ha discutido solo en términos de conveniencia. Álvaro propone un enfoque orientado a las virtudes, sugiriendo que la determinación de producir carne cultivada en el laboratorio proviene de motivos no virtuosos, es decir, "la falta de templanza y la incomprensión del papel de los alimentos en el florecimiento humano".
Algunos han propuesto investigaciones independientes sobre los estándares, leyes y regulaciones para la carne cultivada.
Al igual que con muchos otros alimentos, la carne cultivada necesita métodos de producción técnicamente sofisticados que pueden ser difíciles para algunas comunidades, lo que significa que carecerían de autosuficiencia y dependerían de las corporaciones alimentarias mundiales.
Al establecer un paralelo similar con la carne cultivada, algunos activistas ambientales afirman que adoptar una dieta vegetariana puede ser una forma de enfocarse en acciones personales y gestos justos en lugar de cambios sistémicos. El ecologista Dave Riley afirma que "ser sin carne y sin culpa parece seductoramente simple mientras la destrucción del medio ambiente arrasa a nuestro alrededor", y señala que Mollison "insiste en que el vegetarianismo aleja a los animales del paisaje comestible para que se pierda su contribución a la cadena alimentaria".
Consideraciones religiosas
Las autoridades rabínicas judías no están de acuerdo sobre si la carne cultivada es kosher , es decir, aceptable según la ley y la práctica judías. Un factor es la naturaleza del animal del que se obtienen las células, ya sea una especie kosher o no kosher y si, si las células se tomaron de un animal muerto, se llevó a cabo una matanza religiosa antes de la extracción de las células. La mayoría de las autoridades están de acuerdo en que si las células originales fueron tomadas de un animal sacrificado religiosamente, entonces la carne cultivada será kosher. Dependiendo de la naturaleza de las células, se puede determinar que es kosher incluso cuando se toma de un animal vivo, y algunos han argumentado que sería kosher incluso si proviene de animales no kosher como los cerdos.
También deben tenerse en cuenta las prácticas dietéticas islámicas . El Instituto Islámico del Condado de Orange, California, dijo: "No parece haber ninguna objeción a comer este tipo de carne cultivada". Además, Abdul Qahir Qamar de la Academia Islámica Internacional Fiqh dijo que la carne cultivada "no se considerará carne de animales vivos, sino carne cultivada". Para las células derivadas de cerdos, perros y otros animales haram , la carne se consideraría vegetativa y "similar al yogur y los encurtidos fermentados".
El hinduismo normalmente excluye el consumo de carne de res, como bistec y hamburguesas. Chandra Kaushik, presidente del Hindu Mahasabha , dijo sobre la carne de res cultivada que "no aceptaría que se comercialice en un mercado de ninguna forma ni se utilice con fines comerciales".
Económico
Por el momento, la carne cultivada es significativamente más costosa que la carne convencional. Sin embargo, en una entrevista de marzo de 2015, Post dijo que el costo marginal de la hamburguesa original de 250.000 euros de su equipo era ahora de 8,00 euros. Estimó que los avances tecnológicos permitirían que el producto fuera competitivo en costos con respecto a la carne de res de origen tradicional en aproximadamente diez años. En 2018, Memphis Meats redujo el costo de producción a $ 1,700 por libra. En 2019, Eat Just dijo que producir un nugget de pollo costaba alrededor de 50 dólares.
Desarrollo continuo
Educación
En 2015, la Universidad de Maastricht acogió la primera Conferencia Internacional sobre Carne Cultivada. New Harvest , un instituto de investigación 501 (c) (3), así como The Good Food Institute organizan conferencias anuales para convocar a líderes de la industria, científicos, inversores y colaboradores potenciales. Las dos organizaciones también financian la investigación pública y producen contenido educativo. Organizaciones como Cellular Agriculture Society, Cellular Agriculture Canada, Cellular Agriculture France, Cellular Agriculture Australia y Cellular Agriculture New Zealand se fundaron para defender la carne cultivada en sus respectivos países. También han surgido publicaciones como Cell Agri y Protein Report con el fin de proporcionar actualizaciones sobre la tecnología y los negocios dentro del campo.
Investigar
La investigación continúa en muchos frentes, incluyendo entomocultivo , mapas interactómicos de tejido cardíaco, diseño de sustrato, diseño de andamios, perfil nutricional, cinética de reacción, fenómenos de transporte, limitaciones de transferencia de masa y requisitos estequiométricos metabólicos. y proceso de bioimpresión.
Aceleradores e incubadoras
Múltiples empresas de capital de riesgo y programas de aceleración / incubadora se centran en ayudar a las nuevas empresas de tecnología cultivada o empresas de proteínas de origen vegetal en general. La firma Big Idea Ventures (BIV) Venture Capital lanzó su New Protein Fund para invertir en empresas emergentes de alimentos celulares y vegetales en Nueva York y Singapur. Invirtieron en MeliBio, Actual Veggies, Biftek.co, Orbillion Bio, Yoconut, Evo, WildFor y Novel Farms. Indie Bio es un programa acelerador orientado a la biología que ha invertido en Memphis Meats, Geltor, New Age Meats y Finless Foods.
En la cultura popular
La carne cultivada ha aparecido a menudo en la ciencia ficción . La primera mención puede estar en Two Planets (1897) de Kurd Lasswitz , donde la "carne sintética" es una de las variedades de alimentos sintéticos introducidos en la Tierra por los marcianos. Otros libros notables que mencionan la carne artificial incluyen Ashes, Ashes (1943) de René Barjavel ; Los comerciantes del espacio (1952) de Frederik Pohl y CM Kornbluth ; El restaurante del fin del universo (1980) de Douglas Adams ; Le Transperceneige (Snowpiercer) (1982) de Jacques Lob y Jean-Marc Rochette ; Neuromancer (1984) de William Gibson ; Oryx y Crake (2003) de Margaret Atwood ; Deadstock (2007) de Jeffrey Thomas ; Accelerando (2005) de Charles Stross ; Ware Tetralogy de Rudy Rucker ; Divergente (2011) de Veronica Roth ; y la saga Vorkosigan (1986-2018) de Lois McMaster Bujold .
En el cine, la carne artificial ha aparecido de manera prominente en el drama de Giulio Questi de 1968 La morte ha fatto l'uovo (La muerte puso un huevo ) y en la comedia de 1976 de Claude Zidi L'aile ou la cuisine ( El ala o el muslo ). Los pollos "hechos por el hombre" también aparecen en el horror surrealista de 1977 de David Lynch , Eraserhead . Más recientemente, también se destacó como el tema central de la película Antiviral (2012).
El Starship Enterprise de la franquicia de televisión y películas Star Trek aparentemente proporciona una carne sintética, aunque los equipos de The Next Generation y posteriores usan replicadores .
En la comedia de situación de ABC Better Off Ted (2009-2010), el episodio " Heroes " presenta a Phil ( Jonathan Slavin ) y Lem ( Malcolm Barrett ) tratando de cultivar carne sin vaca.
En el videojuego Project Eden , los personajes del jugador investigan una empresa de carne cultivada llamada Real Meat.
En la película Galaxy Quest, durante la escena de la cena, el personaje de Tim Allen se refiere a que su bistec sabe a "carne de res real de Iowa".
En The Expanse, la carne "cultivada en cubas" se produce para alimentar a las personas que viven en naves espaciales / estaciones espaciales lejos de la Tierra, debido al costo exorbitante de importar carne real.
La carne cultivada fue un tema en un episodio del Informe Colbert el 17 de marzo de 2009.
En febrero de 2014, una startup de biotecnología llamada BiteLabs realizó una campaña para generar apoyo popular para el salami artesanal elaborado con carne cultivada a partir de muestras de tejido de celebridades. La campaña se hizo popular en Twitter , donde los usuarios tuitearon a celebridades pidiéndoles que donaran células musculares al proyecto. Las reacciones de los medios a BiteLabs identificaron a la startup como una sátira sobre la cultura de las startups, la cultura de las celebridades o como un motivo de discusión sobre preocupaciones bioéticas. Si bien BiteLabs afirmó estar inspirado por el éxito de la hamburguesa de Sergey Brin , la empresa se ve como un ejemplo de diseño crítico en lugar de una empresa comercial real.
A finales de 2016, la carne cultivada estuvo involucrado en un caso en el episodio "¿Cómo se hace la salchicha" de la CBS muestran Primaria .
La carne cultivada se describió en el documental canadiense de 2020 Meat the Future .
En el videojuego Cyberpunk 2077 de 2020 , se venden múltiples productos cárnicos cultivados, debido al alto costo de la carne natural. Esto incluye "EEZYBEEF", elaborado a partir de células musculares cultivadas in vitro extraídas de ganado , y el cultivo de gusanos planos "Orgiatic", que viene en varios sabores.
Ver también
- BioArt
- Alimentos BioTech
- Sociedad de agricultura celular
- Desinversión de granjas industriales
- Alimentos frente a piensos
- Cuero cultivado
- Lista de sustitutos de la carne
- Quorn (producto alimenticio)
- Desacoplamiento de recursos
- Sustituto de sopa de aleta de tiburón
- Cronología de la agricultura celular
- Cultivo de tejidos
- Tyson Foods