Virus adenoasociado - Adeno-associated virus
| Virus adenoasociado | |
|---|---|
|
|
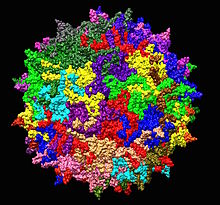
| Estructura del serotipo 2 del virus adenoasociado de 1LP3 . Se muestra un eje quíntuple en el centro. | |
|
clasificación cientifica |
|
| (no clasificado): | Virus |
| Reino : | Monodnaviria |
| Reino: | Shotokuvirae |
| Filo: | Cossaviricota |
| Clase: | Quintoviricetes |
| Orden: | Piccovirales |
| Familia: | Parvoviridae |
| Subfamilia: | Parvovirinae |
| Género: | Dependoparvovirus |
| Los virus incluyen: | |
|
|
Los virus adenoasociados ( AAV ) son pequeños virus que infectan a los seres humanos y algunas otras especies de primates . Pertenecen al género Dependoparvovirus , que a su vez pertenece a la familia Parvoviridae . Son virus pequeños (20 nm ) con replicación defectuosa , sin envoltura y tienen un genoma de ADN monocatenario lineal (ssDNA) de aproximadamente 4,8 kilobases (kb).
Actualmente, no se sabe que los AAV causen enfermedades . Los virus provocan una respuesta inmunitaria muy leve . Varias características adicionales hacen de AAV un candidato atractivo para crear vectores virales para terapia génica y para la creación de modelos de enfermedades humanas isogénicas . Los vectores de terapia génica que utilizan AAV pueden infectar células tanto en división como quiescentes y persistir en un estado extracromosómico sin integrarse en el genoma de la célula huésped, aunque en el virus nativo se produce la integración de genes portados por virus en el genoma del huésped. La integración puede ser importante para determinadas aplicaciones, pero también puede tener consecuencias no deseadas. Los ensayos clínicos recientes en humanos que utilizan AAV para la terapia génica en la retina han demostrado ser prometedores.
Historia
El virus adenoasociado (AAV), que anteriormente se pensaba que era un contaminante en las preparaciones de adenovirus, se identificó por primera vez como dependoparvovirus en la década de 1960 en los laboratorios de Bob Atchison en Pittsburgh y Wallace Rowe en los NIH . Los estudios serológicos en humanos indicaron posteriormente que, a pesar de estar presente en personas infectadas por virus auxiliares como el adenovirus o el virus del herpes, el AAV en sí no causaba ninguna enfermedad.
Uso en terapia génica
Ventajas e inconvenientes
El AAV de tipo salvaje ha atraído un interés considerable por parte de los investigadores de terapia génica debido a una serie de características. El principal de ellos es la aparente falta de patogenicidad del virus. También puede infectar células que no se dividen y tiene la capacidad de integrarse de manera estable en el genoma de la célula huésped en un sitio específico (designado AAVS1) en el cromosoma 19 humano . Esta característica lo hace algo más predecible que los retrovirus , que presentan la amenaza de una inserción aleatoria y de mutagénesis, que a veces es seguida por el desarrollo de un cáncer . El genoma de AAV se integra con mayor frecuencia en el sitio mencionado, mientras que las incorporaciones aleatorias en el genoma tienen lugar con una frecuencia insignificante. Sin embargo, el desarrollo de AAV como vectores de terapia génica ha eliminado esta capacidad integradora mediante la eliminación de rep y cap del ADN del vector. El gen deseado junto con un promotor para impulsar la transcripción del gen se inserta entre las repeticiones terminales invertidas (ITR) que ayudan en la formación de concatémeros en el núcleo después de que el ADN del vector monocatenario es convertido por los complejos de ADN polimerasa de la célula huésped en doble cadena. ADN. Los vectores de terapia génica basados en AAV forman concatémeros episomales en el núcleo de la célula huésped. En las células que no se dividen, estos concatémeros permanecen intactos durante la vida de la célula huésped. Al dividir las células, el ADN de AAV se pierde a través de la división celular, ya que el ADN episomal no se replica junto con el ADN de la célula huésped. La integración aleatoria del ADN de AAV en el genoma del hospedador es detectable, pero ocurre con una frecuencia muy baja. Los AAV también presentan una inmunogenicidad muy baja , aparentemente restringida a la generación de anticuerpos neutralizantes , mientras que no inducen una respuesta citotóxica claramente definida . Esta característica, junto con la capacidad de infectar células inactivas, presenta su dominio sobre los adenovirus como vectores para la terapia génica humana .
El uso del virus presenta algunas desventajas. La capacidad de clonación del vector es relativamente limitada y la mayoría de los genes terapéuticos requieren la sustitución completa del genoma de 4,8 kilobase del virus. Por tanto, los genes grandes no son adecuados para su uso en un vector AAV estándar. Actualmente se están explorando opciones para superar la capacidad de codificación limitada. Las ITR de AAV de dos genomas pueden aparearse para formar concatémeros de cabeza a cola, casi duplicando la capacidad del vector. La inserción de sitios de empalme permite la eliminación de los ITR de la transcripción.
Debido a las ventajas de la terapia génica especializada de AAV, los investigadores han creado una versión alterada de AAV denominada virus adenoasociado autocomplementario (scAAV) . Mientras que el AAV empaqueta una sola hebra de ADN y debe esperar a que se sintetice su segunda hebra, el scAAV empaqueta dos hebras más cortas que son complementarias entre sí. Al evitar la síntesis de la segunda cadena, scAAV puede expresarse más rápidamente, aunque como advertencia, scAAV solo puede codificar la mitad de la capacidad ya limitada de AAV. Informes recientes sugieren que los vectores scAAV son más inmunogénicos que los vectores de adenovirus monocatenarios, lo que induce una activación más fuerte de los linfocitos T citotóxicos .
Se cree que la inmunidad humoral instigada por la infección con el tipo salvaje es común. La actividad neutralizante asociada limita la utilidad del serotipo AAV2 más comúnmente utilizado en determinadas aplicaciones. Por consiguiente, la mayoría de los ensayos clínicos en curso implican la administración de AAV2 al cerebro, un órgano relativamente privilegiado desde el punto de vista inmunológico. En el cerebro, AAV2 es muy específico de neuronas.
Ensayos clínicos
A partir de 2019, los vectores AAV se han utilizado en más de 250 ensayos clínicos en todo el mundo, aproximadamente el 8,3% de los ensayos de terapia génica con vectores de virus. Recientemente, se han obtenido resultados prometedores de ensayos de fase 1 y fase 2 para una serie de enfermedades, incluida la amaurosis congénita de Leber , hemofilia , insuficiencia cardíaca congestiva , atrofia muscular espinal , deficiencia de lipoproteína lipasa y enfermedad de Parkinson .
| Indicación | Gene | Ruta de administración | Fase | Número de asunto | Estado |
| Fibrosis quística | CFTR | Pulmón, vía aerosol | I | 12 | Completo |
| CFTR | Pulmón, vía aerosol | II | 38 | Completo | |
| CFTR | Pulmón, vía aerosol | II | 100 | Completo | |
| Hemofilia B | ARREGLAR | Intramuscular | I | 9 | Completo |
| ARREGLAR | Arteria hepatica | I | 6 | Terminado | |
| Artritis | TNFR: Fc | Intra-articular | I | 1 | En curso |
| Enfisema hereditario | AAT | Intramuscular | I | 12 | En curso |
| Amaurosis congénita de Leber | RPE65 | Subretinal | I – II | Múltiple | Varios en curso y completos |
| La degeneración macular relacionada con la edad | sFlt-1 | Subretinal | I – II | 24 | En curso |
| Distrofia muscular de Duchenne | SGCA | Intramuscular | I | 10 | En curso |
| enfermedad de Parkinson | GAD65 , GAD67 | Intracraneal | I | 12 | Completo |
| Enfermedad de Canavan | CAA | Intracraneal | I | 21 | En curso |
| Enfermedad de Batten | CLN2 | Intracraneal | I | 10 | En curso |
| Enfermedad de Alzheimer | NGF | Intracraneal | I | 6 | En curso |
| Atrofia muscular en la columna | SMN1 | Intravenosa e intratecal | I – III | 15 | Varios en curso y completos |
| Insuficiencia cardíaca congestiva | SERCA2a | Intracoronario | IIb | 250 | En curso |
Estructura
Genoma, transcriptoma y proteoma
El genoma de AAV está formado por ácido desoxirribonucleico monocatenario ( ADN ss ), de detección positiva o negativa, que tiene aproximadamente 4,7 kilobase de longitud. El genoma comprende ITR en ambos extremos de la cadena de ADN y dos marcos de lectura abiertos (ORF): rep y cap . El primero está compuesto por cuatro genes superpuestos que codifican las proteínas Rep necesarias para el ciclo de vida de AAV, y el último contiene secuencias de nucleótidos superpuestas de proteínas de la cápside : VP1, VP2 y VP3, que interactúan para formar una cápside con simetría icosaédrica.
Secuencias de ITR
Las secuencias de repetición terminal invertida (ITR) comprenden 145 bases cada una. Fueron nombrados así debido a su simetría, que se demostró que era necesaria para la multiplicación eficiente del genoma de AAV. La característica de estas secuencias que les confiere esta propiedad es su capacidad para formar una horquilla , lo que contribuye al llamado autocebado que permite la síntesis independiente de primasa de la segunda hebra de ADN. También se demostró que las ITR son necesarias tanto para la integración del ADN del VAA en el genoma de la célula huésped (cromosoma 19 en humanos) como para el rescate de él, así como para la encapsidación eficiente del ADN del VAA combinado con la generación de una desoxirribonucleasa completamente ensamblada. -partículas AAV resistentes.
Con respecto a la terapia génica, las ITR parecen ser las únicas secuencias requeridas en cis junto al gen terapéutico: las proteínas estructurales ( cap ) y de empaquetamiento ( rep ) pueden administrarse en trans . Con esta suposición se establecieron muchos métodos para la producción eficiente de vectores de AAV recombinantes (rAAV) que contienen un gen informador o terapéutico. Sin embargo, también se publicó que las ITR no son los únicos elementos requeridos en cis para la replicación y encapsidación efectivas. Algunos grupos de investigación han identificado una secuencia denominada elemento dependiente de Rep que actúa en cis (CARE) dentro de la secuencia codificante del gen rep . Se demostró que CARE aumenta la replicación y encapsidación cuando está presente en cis .
Rep gen y proteínas Rep
En el "lado izquierdo" del genoma hay dos promotores llamados p5 y p19, a partir de los cuales se pueden producir dos ácidos ribonucleicos mensajeros ( ARNm ) superpuestos de diferente longitud. Cada uno de estos contiene un intrón que puede empalmarse o no. Dadas estas posibilidades, se pueden sintetizar cuatro ARNm diferentes y, en consecuencia, cuatro proteínas Rep diferentes con secuencia superpuesta. Sus nombres representan sus tamaños en kilodaltons (kDa): Rep78, Rep68, Rep52 y Rep40. Rep78 y 68 pueden unir específicamente la horquilla formada por el ITR en el acto de autocebado y escindir en una región específica, el sitio de resolución terminal designado, dentro de la horquilla. También se demostró que eran necesarios para la integración específica de AAVS1 del genoma de AAV. Se demostró que las cuatro proteínas Rep se unen a ATP y poseen actividad helicasa . También se demostró que regulan positivamente la transcripción del promotor p40 (mencionado a continuación), pero regulan negativamente los promotores p5 y p19.
cap gen y proteínas VP
El lado derecho de un genoma de AAV de detección positiva codifica secuencias superpuestas de tres proteínas de la cápside, VP1, VP2 y VP3, que parten de un promotor, denominado p40. Los pesos moleculares de estas proteínas son 87, 72 y 62 kiloDaltons, respectivamente. La cápside de AAV está compuesta por una mezcla de VP1, VP2 y VP3 que totalizan 60 monómeros dispuestos en simetría icosaédrica en una proporción de 1: 1: 10, con un tamaño estimado de 3,9 MegaDaltons. La estructura cristalina de la proteína VP3 fue determinada por Xie, Bue, et al.
El gen cap produce una proteína no estructural adicional llamada proteína activadora de ensamblaje (AAP). Esta proteína se produce a partir de ORF2 y es esencial para el proceso de ensamblaje de la cápside. La función exacta de esta proteína en el proceso de ensamblaje y su estructura no se han resuelto hasta la fecha.
Los tres VP se traducen a partir de un ARNm. Una vez que se sintetiza este ARNm, se puede empalmar de dos maneras diferentes: se puede escindir un intrón más largo o más corto, lo que da como resultado la formación de dos grupos de ARNm: un grupo de ARNm de 2,3 kb y uno de 2,6 kb de longitud. Habitualmente, especialmente en presencia de adenovirus , se prefiere el intrón más largo, por lo que el ARNm de 2,3 kb de longitud representa el llamado "empalme principal". De esta forma , se corta el primer codón AUG , a partir del cual comienza la síntesis de la proteína VP1, lo que da como resultado un nivel general reducido de síntesis de la proteína VP1. El primer codón AUG que permanece en el corte y empalme principal es el codón de iniciación de la proteína VP3. Sin embargo, corriente arriba de ese codón en el mismo marco de lectura abierto se encuentra una secuencia ACG (que codifica treonina) que está rodeada por un contexto Kozak óptimo . Esto contribuye a un bajo nivel de síntesis de la proteína VP2, que en realidad es la proteína VP3 con residuos N terminales adicionales, al igual que VP1.
Dado que se prefiere empalmar el intrón más grande, y dado que en el empalme principal el codón ACG es una señal de iniciación de la traducción mucho más débil , la proporción a la que se sintetizan in vivo las proteínas estructurales de AAV es de aproximadamente 1: 1: 20, que es lo mismo que en la partícula de virus maduro. Se demostró que el fragmento único en el extremo N de la proteína VP1 posee la actividad fosfolipasa A2 (PLA2), que probablemente se requiere para la liberación de partículas de AAV de los endosomas tardíos . Muralidhar y col. informó que VP2 y VP3 son cruciales para el ensamblaje correcto del virión. Más recientemente, sin embargo, Warrington et al. mostró que VP2 es innecesaria para la formación completa de partículas de virus y una infectividad eficiente, y también presentó que VP2 puede tolerar grandes inserciones en su terminal N, mientras que VP1 no puede, probablemente debido a la presencia del dominio PLA2.
Clasificación, serotipos, receptores y tropismo nativo
Dos especies de AAV fueron reconocidas por el Comité Internacional de Taxonomía de Virus en 2013: dependoparvovirus A adenoasociado (anteriormente AAV-1, -2, -3 y -4) y dependoparvovirus B adenoasociado (anteriormente AAV-5).
Hasta la década de 1990, prácticamente toda la biología del AAV se estudió utilizando el serotipo 2 del AAV. Sin embargo, el AAV es muy prevalente en humanos y otros primates y se han aislado varios serotipos de diversas muestras de tejido. Los serotipos 2, 3, 5 y 6 se descubrieron en células humanas, los serotipos AAV 1, 4 y 7–11 en muestras de primates no humanos. A partir de 2006 se han descrito 11 serotipos de AAV , el undécimo en 2004. Las proteínas de la cápside de AAV contienen 12 regiones de superficie hipervariables, con la mayor variabilidad en los tres picos proximales, pero el genoma del parvovirus en general presenta genes estructurales y de replicación muy conservados entre los serotipos. . Todos los serotipos conocidos pueden infectar células de múltiples tipos de tejidos diversos. La especificidad del tejido está determinada por el serotipo de la cápside y la pseudotipificación de los vectores AAV para alterar su rango de tropismo probablemente será importante para su uso en terapia.
Serotipo 2
El serotipo 2 (AAV2) ha sido el más examinado hasta ahora. El AAV2 presenta un tropismo natural hacia los músculos esqueléticos , las neuronas , las células del músculo liso vascular y los hepatocitos .
Se han descrito tres receptores celulares para AAV2: proteoglicano de heparán sulfato (HSPG), una integrina V β 5 y receptor 1 del factor de crecimiento de fibroblastos (FGFR-1). El primero funciona como un receptor primario, mientras que los dos últimos tienen una actividad de correceptor y permiten que AAV ingrese a la célula por endocitosis mediada por receptores . Los resultados de estos estudios han sido cuestionados por Qiu, Handa, et al. HSPG funciona como el receptor principal, aunque su abundancia en la matriz extracelular puede eliminar las partículas de AAV y afectar la eficacia de la infección.
Los estudios han demostrado que el serotipo 2 del virus (AAV-2) aparentemente mata las células cancerosas sin dañar las sanas. "Nuestros resultados sugieren que el virus adenoasociado tipo 2, que infecta a la mayoría de la población pero no tiene efectos nocivos conocidos, mata varios tipos de células cancerosas pero no tiene ningún efecto sobre las células sanas", dijo Craig Meyers, profesor de inmunología y microbiología en el Penn State College of Medicine en Pennsylvania en 2005. Esto podría conducir a un nuevo agente contra el cáncer.
Otros serotipos
Aunque AAV2 es el serotipo más popular en varias investigaciones basadas en AAV, se ha demostrado que otros serotipos pueden ser más eficaces como vectores de suministro de genes. Por ejemplo, AAV6 parece mucho mejor para infectar células epiteliales de las vías respiratorias, AAV7 presenta una tasa de transducción muy alta de células de músculo esquelético murino (similar a AAV1 y AAV5), AAV8 es excelente en la transducción de hepatocitos y AAV1 y 5 demostraron ser muy eficientes en la entrega de genes. a las células endoteliales vasculares. En el cerebro, la mayoría de los serotipos de AAV muestran tropismo neuronal, mientras que AAV5 también transduce astrocitos. AAV6, un híbrido de AAV1 y AAV2, también muestra menor inmunogenicidad que AAV2.
Los serotipos pueden diferir con respecto a los receptores a los que están unidos. Por ejemplo, la transducción de AAV4 y AAV5 puede inhibirse mediante ácidos siálicos solubles (de forma diferente para cada uno de estos serotipos), y se demostró que AAV5 entraba en las células a través del receptor del factor de crecimiento derivado de plaquetas .
Serotipos sintéticos
Se han realizado muchos esfuerzos para diseñar y mejorar nuevas variantes de AAV con fines clínicos y de investigación. Tales modificaciones incluyen nuevos tropismos para atacar tejidos específicos y residuos superficiales modificados para evadir la detección por parte del sistema inmunológico. Más allá de optar por cepas particulares de AAV recombinante (rAAV) para apuntar a células particulares, los investigadores también han explorado el pseudotipado de AAV, la práctica de crear híbridos de ciertas cepas de AAV para acercarse a un objetivo aún más refinado. El híbrido se crea tomando una cápside de una cepa y el genoma de otra cepa. Por ejemplo, la investigación que involucró a AAV2 / 5, un híbrido con el genoma de AAV2 y la cápside de AAV5, pudo lograr más precisión y rango en las células cerebrales de lo que AAV2 podría lograr sin hibridar. Los investigadores han seguido experimentando con pseudotipificación mediante la creación de cepas con cápsides híbridas. AAV-DJ tiene una cápside híbrida de ocho cepas diferentes de AAV; como tal, puede infectar diferentes células en muchas áreas del cuerpo, una propiedad que no tendría una sola cepa de AAV con un tropismo limitado. Otros esfuerzos para diseñar y mejorar nuevas variantes de AAV han involucrado la reconstrucción ancestral de variantes de virus para generar nuevos vectores con propiedades mejoradas para aplicaciones clínicas y el estudio de la biología de AAV.
Inmunología
El VAA es de particular interés para los terapeutas génicos debido a su aparente capacidad limitada para inducir respuestas inmunes en humanos, un factor que debería influir positivamente en la eficacia de la transducción del vector al tiempo que reduce el riesgo de cualquier patología asociada al sistema inmunitario .
No se considera que AAV tenga ningún papel conocido en la enfermedad.
Sin embargo, la respuesta del sistema inmunológico del huésped y la tolerancia inmunitaria reducen la eficacia de la terapia génica mediada por AAV. Se ha demostrado que la respuesta inmune del huésped responde a los vectores AAV, las células transducidas y las proteínas transducidas. La respuesta inmune se puede subdividir en dos categorías: innata y adaptativa, la última de las cuales se divide en humoral y mediada por células.
Innato
La respuesta inmune innata a los vectores AAV se ha caracterizado en modelos animales. La administración intravenosa en ratones provoca una producción transitoria de citocinas proinflamatorias y cierta infiltración de neutrófilos y otros leucocitos en el hígado, que parece secuestrar un gran porcentaje de las partículas virales inyectadas. Tanto los niveles de factor soluble como la infiltración celular parecen volver a los valores iniciales en seis horas. Por el contrario, los virus más agresivos producen respuestas innatas que duran 24 horas o más.
Los estudios in vivo indican que los vectores AAV interactúan con las vías del receptor tipo Toll (TLR) 9 y TLR2-MyD88 para desencadenar la respuesta inmune innata estimulando la producción de interferones. Se ha demostrado que los ratones deficientes en TLR9 son más receptivos al tratamiento con AAV y demuestran niveles más altos de expresión transgénica.
Humoral
Debido a una infección natural previa, muchas personas tienen anticuerpos neutralizantes (NAb) preexistentes contra los AAV, lo que puede dificultar significativamente su aplicación en la terapia génica. Aunque los AAV son muy variables entre las variantes sintéticas y de tipo salvaje, los sitios de reconocimiento de anticuerpos pueden conservarse evolutivamente.
Se sabe que el virus instiga una sólida inmunidad humoral en modelos animales y en la población humana, donde se cree que hasta el 80% de los individuos son seropositivos para AAV2. Se sabe que los anticuerpos son neutralizantes y, para las aplicaciones de terapia génica, estos tienen un impacto en la eficacia de la transducción del vector a través de algunas vías de administración. Además de los niveles persistentes de anticuerpos específicos de AAV, tanto de los estudios de estimulación inicial en animales como de los ensayos clínicos se desprende que la memoria de las células B también es fuerte. En seres humanos seropositivos, los anticuerpos IgG circulantes para AAV2 parecen estar compuestos principalmente por las subclases IgG1 e IgG2, con poca o ninguna IgG3 o IgG4 presente.
Mediado por células
La respuesta mediada por células al virus y a los vectores está mal caracterizada y se ha ignorado en gran medida en la bibliografía tan recientemente como en 2005. Los ensayos clínicos que utilizan un vector basado en AAV2 para tratar la hemofilia B parecen indicar que la destrucción dirigida de células transducidas puede estar ocurriendo. En combinación con los datos que muestran que las células T CD8 + pueden reconocer elementos de la cápside de AAV in vitro , parece que puede haber una respuesta de linfocitos T citotóxicos a los vectores de AAV. Las respuestas citotóxicas implicarían la participación de células T auxiliares CD4 + en la respuesta a AAV y los datos in vitro de estudios en humanos sugieren que el virus puede inducir tales respuestas, incluidas las respuestas de memoria Th1 y Th2. Se han identificado varios epítopos estimulantes de células T candidatos dentro de la proteína de la cápside de AAV VP1, que pueden ser dianas atractivas para la modificación de la cápside si el virus se va a utilizar como vector para terapia génica.
Ciclo de infección
Hay varios pasos en el ciclo de infección de AAV, desde infectar una célula hasta producir nuevas partículas infecciosas:
- apego a la membrana celular
- endocitosis mediada por receptores
- tráfico de endosomas
- escapar del endosoma tardío o lisosoma
- translocación al núcleo
- destapando
- formación de la forma replicativa del ADN bicatenario del genoma de AAV
- expresión de genes rep
- replicación del genoma
- expresión de genes cap , síntesis de partículas de ssDNA de la progenie
- ensamblaje de viriones completos , y
- liberación de la célula infectada.
Algunos de estos pasos pueden verse diferentes en varios tipos de células, lo que, en parte, contribuye al tropismo nativo definido y bastante limitado de AAV. La replicación del virus también puede variar en un tipo de célula, dependiendo de la fase actual del ciclo celular de la célula .
El rasgo característico del virus adenoasociado es una deficiencia en la replicación y, por lo tanto, su incapacidad para multiplicarse en células no afectadas. El virus adenoasociado se propaga al coinfectar una célula con un virus auxiliar. El primer virus auxiliar que se describió como que proporcionaba una generación exitosa de nuevas partículas de AAV fue el adenovirus , a partir del cual se originó el nombre de AAV. Luego se demostró que la replicación de AAV puede ser facilitada por proteínas seleccionadas derivadas del genoma de adenovirus, por otros virus como HSV o vaccinia, o por agentes genotóxicos, como irradiación UV o hidroxiurea . Dependiendo de la presencia o ausencia de un virus auxiliar, el ciclo de vida del VAA sigue una ruta lítica o lisogénica, respectivamente. Si hay un virus auxiliar, la expresión del gen de AAV se activa, lo que permite que el virus se replique utilizando la polimerasa de la célula huésped. Cuando el virus auxiliar mata a la célula huésped, se liberan los nuevos viriones AAV. Si no hay un virus auxiliar presente, el VAA presenta un comportamiento lisogénico. Cuando AAV infecta una célula sola, su expresión génica se reprime (AAV no se replica) y su genoma se incorpora al genoma del huésped (en el cromosoma 19 humano). En casos raros, la lisis puede ocurrir sin un virus auxiliar, pero generalmente el AAV no puede replicarse y matar una célula por sí solo.
El conjunto mínimo de genes adenovirales necesarios para la generación eficiente de partículas de AAV de la progenie fue descubierto por Matsushita, Ellinger et al. Este descubrimiento permitió nuevos métodos de producción de AAV recombinantes, que no requieren coinfección adenoviral de las células productoras de AAV. En ausencia de virus auxiliares o factores genotóxicos, el ADN de AAV puede integrarse en el genoma del hospedador o persistir en forma episomal . En el primer caso, la integración está mediada por las proteínas Rep78 y Rep68 y requiere la presencia de ITR que flanquean la región que se integra. En ratones, se ha observado que el genoma de AAV persiste durante largos períodos de tiempo en tejidos inactivos, como los músculos esqueléticos, en forma episomal (una conformación circular de la cabeza a la cola).
Ver también
- Modelos de enfermedades humanas isogénicas
- AAV oncolítico
- Ingeniería genómica recombinante mediada por AAV
Referencias
enlaces externos
- Kimball JW (17 de mayo de 2015). "Terapia génica II" . Páginas de biología de Kimball . Archivado desde el original el 18 de marzo de 2005 . Consultado el 13 de mayo de 2005 .
- " Virus adenoasociado " . Navegador de taxonomía NCBI . 272636.