Escherichia coli shigatoxigénica y verotoxigénica -Shigatoxigenic and verotoxigenic Escherichia coli
| E. coli shigatoxigénica y verotoxigénica | |
|---|---|
| Especialidad | Enfermedad infecciosa |
Escherichia coli shigatoxigénica ( STEC ) y E. coli verotoxigénica ( VTEC ) son cepas de la bacteria Escherichia coli que producen toxina Shiga o toxina similar a Shiga (verotoxina). Solo una minoría de las cepas causan enfermedades en los seres humanos. Los que lo hacen son conocidos colectivamente como enterohemorrágica E. coli ( EHEC ) y son las principales causas de enfermedades transmitidas por alimentos . Cuando infectan a los humanos, a menudo causan gastroenteritis , enterocolitis y diarrea sanguinolenta (de ahí el nombre "enterohemorrágico") y, a veces, causan una complicación grave llamada síndrome urémico hemolítico (SUH). El grupo y sus subgrupos se conocen por varios nombres . Se distinguen de otras cepas de patógenos intestinales de E. coli incluyendo enterotoxigénica de E. coli (ETEC), enteropatógenas de E. coli (EPEC), enteroinvasiva E. coli (EIEC), enteroagregativa E. coli (CEEA), y adherente de forma difusa E. coli (DAEC).
Fondo
La más conocida de estas cepas es la O157: H7 , pero las cepas distintas de la O157 causan aproximadamente 36.000 enfermedades, 1.000 hospitalizaciones y 30 muertes en los Estados Unidos al año. Los especialistas en seguridad alimentaria reconocen las cepas "Big Six": O26; O45; O103; O111; O121 ; y O145. Un brote de 2011 en Alemania fue causado por otra STEC, O104: H4 . Esta cepa tiene propiedades tanto enteroagregantes como enterohemorrágicas. Tanto la cepa O145 como la O104 pueden causar síndrome urémico hemolítico (SUH); se ha demostrado que la primera cepa representa del 2% al 51% de los casos de SUH conocidos; Se estima que el 56% de estos casos son causados por O145 y el 14% por otras cepas de ECEH.
Los ECEH que inducen diarrea sanguinolenta provocan SUH en el 10% de los casos. Las manifestaciones clínicas del SUH posdiarreico incluyen insuficiencia renal aguda , anemia hemolítica microangiopática y trombocitopenia . La verocitotoxina (toxina similar a la shiga) puede dañar directamente las células renales y endoteliales. La trombocitopenia ocurre cuando las plaquetas se consumen por coagulación. La anemia hemolítica es el resultado del depósito de fibrina intravascular , aumento de la fragilidad de los glóbulos rojos y fragmentación.
Los antibióticos tienen un valor cuestionable y no han demostrado tener un beneficio clínico claro. Se ha demostrado que los antibióticos que interfieren con la síntesis de ADN, como las fluoroquinolonas , inducen el bacteriófago portador de Stx y aumentan la producción de toxinas. Los intentos de bloquear la producción de toxinas con antibacterianos que se dirigen a la síntesis de proteínas ribosómicas son conceptualmente más atractivos. El intercambio de plasma ofrece un tratamiento controvertido pero posiblemente útil. Se debe evitar el uso de agentes antimotilidad (medicamentos que suprimen la diarrea al retardar el tránsito intestinal) en niños menores de 10 años o en pacientes ancianos, ya que aumentan el riesgo de SUH con infecciones por ECEH.
La presentación clínica varía desde una diarrea leve y sin complicaciones hasta una colitis hemorrágica con dolor abdominal intenso. El serotipo O157: H7 puede desencadenar una dosis infecciosa con 100 células bacterianas o menos; otra cepa como la 104: H4 también causó un brote en Alemania en 2011. Las infecciones son más comunes en los meses cálidos y en niños menores de cinco años y generalmente se adquieren a partir de carne de res cruda y leche y jugo no pasteurizados. Inicialmente, se desarrolla una diarrea no sanguinolenta en pacientes después de que la bacteria se adhiere al epitelio o al íleon terminal , ciego y colon . La posterior producción de toxinas media la diarrea sanguinolenta. En los niños, una complicación puede ser el síndrome urémico hemolítico que luego usa citotoxinas para atacar las células en el intestino, de modo que las bacterias pueden filtrarse a la sangre y causar daño endotelial en lugares como el riñón al unirse a la globotriaosilceramida (Gb3).
Nombres
Los nombres del grupo y sus subgrupos incluyen lo siguiente. Hay algo de polisemia involucrada. La sinonimidad invariable se indica por tener el mismo color. Más allá de eso, también hay una sinonimidad más amplia pero variable. Los dos primeros (púrpura) en su sentido más estricto generalmente se tratan como hiperónimos de los demás (rojo y azul), aunque en un uso menos preciso , el rojo y el azul a menudo se han tratado como sinónimos del púrpura. Al menos una referencia sostiene que "EHEC" se excluye mutuamente de "VTEC" y "STEC", pero esto no coincide con el uso común, ya que muchas más publicaciones agrupan todas estas últimas con las primeras.
La opinión actual basada en la microbiología sobre la "toxina similar a Shiga" (SLT) o la "verotoxina" es que todas deberían denominarse (versiones de) toxina Shiga , ya que la diferencia es insignificante. Siguiendo esta vista, todos los "VTEC" (azul) deberían llamarse "STEC" (rojo). Históricamente, a veces se usaba un nombre diferente porque las toxinas no son exactamente las mismas que las que se encuentran en Shigella dysenteriae , hasta el último residuo de aminoácido, aunque según esta lógica, cada "STEC" sería una "VTEC". La línea también se puede extraer de usar "STEC" para Stx1 cepas productoras y "VTEC" para Stx2 cepas productoras, ya Stx1 está más cerca de la toxina Shiga. En la práctica, la elección de palabras y categorías no es tan importante como la comprensión de la relevancia clínica.
| Nombre | Forma corta |
|---|---|
| E. coli enterohemorrágica | EHEC |
| E. coli enterohemorrágica asociada al síndrome urémico hemolítico | HUSEC |
| E. coli productora de toxina shiga | STEC |
| E. coli shigatoxigénica | STEC |
| E. coli productora de toxina similar a shiga | SLTEC |
| E. coli productora de verotoxina | VTEC |
| E. coli verotoxigénica | VTEC |
| E. coli productora de verocitotoxina | VTEC |
| E. coli verocitotoxigénica | VTEC |
Infectividad y virulencia
La infectividad o virulencia de una cepa de ECEH depende de varios factores, incluida la presencia de fucosa en el medio, la detección de este azúcar y la activación de la isla de patogenicidad de ECEH .
Regulación de la isla de patogenicidad
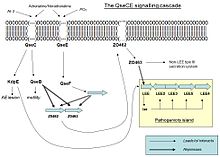
La EHEC se vuelve patógena a través de la expresión del locus de borramiento de enterocitos (LEE) codificado en su isla de patogenicidad. Sin embargo, cuando EHEC no está en un huésped, esta expresión es un desperdicio de energía y recursos, por lo que solo se activa si se detectan algunas moléculas en el ambiente.
Cuando QseC o QseE se unen con una de sus moléculas de señalización que interactúan, se autofosforilan y transfieren su fosfato al regulador de respuesta. QseC detecta adrenalina , noradrenalina y una endonucleasa I-SceIII, codificada por un intrón del grupo móvil I dentro del gen COX1 mitocondrial (AI3); mientras que QseE detecta adrenalina, noradrenalina, SO4 y PO4. Estas señales son una clara indicación para las bacterias de que ya no están libres en el medio ambiente, sino en el intestino.
Como resultado, QseC fosforila QseB (que activa los flagelos), KpdE (que activa el LEE) y QseF. QseE fosforila QseF. Los productos QseBC y QseEF reprimen la expresión de FusK y FusR. FusK y FusR son los dos componentes de un sistema para reprimir la transcripción de los genes LEE. FusK es una cinasa sensor que puede detectar muchos azúcares entre los que se encuentra la fucosa. Cuando la fucosa está presente en el medio, FusK fosforila a FusR que reprime la expresión de LEE.
Por lo tanto, cuando EHEC ingresa al intestino, hay una competencia entre las señales que provienen de QseC y QseF, y la señal que proviene de FusK. A los dos primeros les gustaría activar la virulencia, pero Fusk la detiene porque la capa mucosa, que es fuente de fucosa, aísla los enterocitos de las bacterias haciendo inútil la síntesis de los factores de virulencia. Sin embargo, cuando la concentración de fucosa disminuye porque las células bacterianas encuentran un área desprotegida del epitelio, la expresión de genes LEE no será reprimida por FusR y KpdE los activará fuertemente. En resumen, el efecto combinado de QseC / QseF y FusKR proporciona un sistema de ajuste fino de la expresión de LEE que ahorra energía y permite que los mecanismos de virulencia se expresen solo cuando las posibilidades de éxito son mayores.
Complejo FusKR
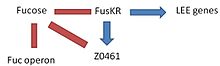
Este complejo, formado por dos componentes (FusK y FusR) tiene la función en EHEC de detectar la presencia de fucosa en el ambiente y regular la activación de genes LEE.
- FusK: está codificado por el gen z0462. Este gen es un sensor de histidina quinasa. Detecta la fucosa y luego fosforila el gen Z0463 activándolo.
- FusR: está codificado por el gen z0463. Este gen es un represor de los genes LEE. Cuando el gen z0462 detecta fucosa, fosforila y activa el gen Z0463, que reprimirá la expresión de 'le r', el regulador de los genes LEE. Si el gen z0463 no está activo, la expresión del gen ler no se reprimiría. La expresión de 'ler' activa los genes restantes en la isla de patogenicidad induciendo virulencia.
- Al mismo tiempo, el sistema FusKR inhibe el gen Z0461, un transportador de fucosa.
La fucosa aumenta la activación del sistema FusKR, que inhibe el gen z0461, que controla el metabolismo de la fucosa. Este es un mecanismo que es útil para evitar la competencia de la fucosa con otras cepas de E. coli que suelen ser más eficaces en el uso de la fucosa como fuente de carbono. Las altas concentraciones de fucosa en el medio también aumentan la represión de los genes LEE.
Con niveles bajos de fucosa en el medio ambiente, el sistema FusKR está inactivo, y esto significa que el gen z0461 se transcribe, aumentando así el metabolismo de la fucosa. Además, una baja concentración de fucosa es un indicio de epitelio desprotegido, por lo que la represión de los genes ler desaparecerá y la expresión de los genes LEE permitirá atacar las células adyacentes.
Ver también
Notas
Referencias
Otras lecturas
- Bardiau, M .; M. Szalo y JG Mainil (2010). "Adhesión inicial de EPEC, EHEC y VTEC a las células huésped" . Vet Res . 41 (5): 57. doi : 10.1051 / vetres / 2010029 . PMC 2881418 . PMID 20423697 .
- Wong, AR; et al. (2011). "Escherichia coli enteropatógena y enterohemorrágica: elementos aún más subversivos" . Mol Microbiol . 80 (6): 1420–38. doi : 10.1111 / j.1365-2958.2011.07661.x . PMID 21488979 . S2CID 24606261 .
- Tatsuno, I. (2007). "[Adherencia de Escherichia coli O157: H7 enterohemorrágica a las células epiteliales humanas]" . Nihon Saikingaku Zasshi . 62 (2): 247–53. doi : 10.3412 / jsb.62.247 . PMID 17575791 .
- Kaper, JB; JP Nataro y HL Mobley (2004). "Escherichia coli patógena". Nat Rev Microbiol . 2 (2): 123–40. doi : 10.1038 / nrmicro818 . PMID 15040260 . S2CID 3343088 .
- García, A .; JG Fox y TE Besser (2010). "Escherichia coli zoonótica enterohemorrágica: una perspectiva de una sola salud" . ILAR J . 51 (3): 221–32. doi : 10.1093 / ilar.51.3.221 . PMID 21131723 .
- Shimizu, T. (2010). "[Expresión y liberación extracelular de la toxina Shiga en Escherichia coli enterohemorrágica]" . Nihon Saikingaku Zasshi . 65 (2–4): 297–308. doi : 10.3412 / jsb.65.297 . PMID 20505269 .
enlaces externos
| Clasificación |
|---|