Doxorrubicina - Doxorubicin
 | |
 | |
| Datos clinicos | |
|---|---|
| Pronunciación | / ˌ d ɒ k s ə r U b ɪ s ɪ n / |
| Nombres comerciales | Adriamicina, Caelyx, Myocet, otros |
| AHFS / Drugs.com | Monografía |
| MedlinePlus | a682221 |
| Datos de licencia | |
Categoría de embarazo |
|
| Vías de administración |
intravenoso , intravesical |
| Código ATC | |
| Estatus legal | |
| Estatus legal | |
| Datos farmacocinéticos | |
| Biodisponibilidad | 5% (por vía oral) |
| Enlace proteico | 75% |
| Metabolismo | Hígado |
| Vida media de eliminación | Trifásico; 12 minutos, 3,3 horas, 30 horas. Media: 1 a 3 horas |
| Excreción | Orina (5 a 12%), heces (40 a 50%) |
| Identificadores | |
| |
| Número CAS | |
| PubChem CID | |
| IUPHAR / BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| CHEBI | |
| CHEMBL | |
| Tablero CompTox ( EPA ) | |
| Tarjeta de información ECHA |
100.041.344 |
| Datos químicos y físicos | |
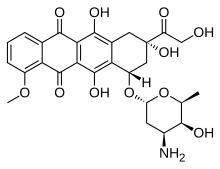
| Fórmula | C 27 H 29 N O 11 |
| Masa molar | 543,525 g · mol −1 |
| Modelo 3D ( JSmol ) | |
| |
| |
|
| |
La doxorrubicina , que se vende bajo la marca Adriamycin entre otros, es un medicamento de quimioterapia que se usa para tratar el cáncer . Esto incluye cáncer de mama , cáncer de vejiga , sarcoma de Kaposi , linfoma y leucemia linfocítica aguda . A menudo se usa junto con otros agentes de quimioterapia . La doxorrubicina se administra mediante inyección en una vena .
Los efectos secundarios comunes incluyen pérdida de cabello , supresión de la médula ósea , vómitos , sarpullido e inflamación de la boca . Otros efectos secundarios graves pueden incluir reacciones alérgicas como anafilaxia , daño cardíaco , daño tisular en el lugar de la inyección, recuperación de la radiación y leucemia relacionada con el tratamiento . Las personas a menudo experimentan una decoloración roja de la orina durante unos días. La doxorrubicina pertenece a la familia de medicamentos antraciclina y antibióticos antitumorales . Funciona en parte interfiriendo con la función del ADN .
La doxorrubicina fue aprobada para uso médico en los Estados Unidos en 1974. Está en la Lista de Medicamentos Esenciales de la Organización Mundial de la Salud . También están disponibles versiones pegiladas y en liposomas ; sin embargo, son más caras. La doxorrubicina se fabricó originalmente a partir de la bacteria Streptomyces peucetius .
Usos médicos
La doxorrubicina se usa comúnmente para tratar algunas leucemias y linfoma de Hodgkin , así como cánceres de vejiga , mama , estómago , pulmón , ovarios , tiroides , sarcoma de tejidos blandos , mieloma múltiple y otros. Comúnmente se usa doxorubicina que contiene regímenes son AC (adriamicina, ciclofosfamida ), TAC ( taxotere , AC), ABVD (adriamicina, bleomicina , vinblastina , dacarbazina ), BEACOPP , CHOP (ciclofosfamida, hidroxidaunorubicina, vincristina , prednisona ) y FAC ( 5-fluorouracilo , adriamicina, ciclofosfamida).
Doxil (ver más abajo) se usa principalmente para el tratamiento del cáncer de ovario donde la enfermedad ha progresado o recurrido después de la quimioterapia a base de platino , o para el tratamiento del sarcoma de Kaposi relacionado con el SIDA .
Efectos secundarios
Cardiotoxicidad
El efecto secundario más peligroso de la doxorrubicina es la miocardiopatía dilatada , que conduce a insuficiencia cardíaca congestiva . La tasa de miocardiopatía depende de su dosis acumulativa, con una incidencia de alrededor del 4% cuando la dosis de doxorrubicina es de 500 a 550 mg / m 2 , del 18% cuando la dosis es de 551 a 600 mg / m 2 y del 36% cuando la dosis es supera los 600 mg / m 2 . Hay varias formas en las que se cree que la doxorrubicina causa miocardiopatía, incluido el estrés oxidativo , la regulación a la baja de genes para proteínas contráctiles y la apoptosis mediada por p53 .
La miocardiopatía inducida por doxorrubicina generalmente da como resultado una miocardiopatía dilatada, con agrandamiento de las cuatro cámaras cardíacas. Esto resulta en disfunción tanto sistólica como diastólica. Eventualmente, puede producirse insuficiencia cardíaca, que conlleva una tasa de mortalidad del 50%. No existe un tratamiento eficaz contra la miocardiopatía establecida causada por el fármaco a partir de 2010. El fármaco dexrazoxano puede usarse para disminuir el riesgo de cardiotoxicidad de la doxorrubicina en ciertos casos.
Otro
Otra complicación común y potencialmente mortal de la doxorrubicina es la tiflitis , una inflamación aguda del intestino que pone en peligro la vida. Además, algunas personas pueden desarrollar EPP , que se caracteriza por erupciones cutáneas en las palmas de las manos o las plantas de los pies, hinchazón, dolor y eritema . Debido a estos efectos secundarios y su color rojo, la doxorrubicina se ha ganado el apodo de "diablo rojo" o "muerte roja".
La quimioterapia puede provocar la reactivación de la hepatitis B y los regímenes que contienen doxorrubicina no son una excepción.
La doxorrubicina y varios fármacos quimioterapéuticos (incluida la ciclofosfamida) pueden provocar una pérdida de pigmentación de la piel .
Formulaciones liposomales
Existe una forma de doxorrubicina encapsulada en liposomas pegilada (recubierta de polietilenglicol) , desarrollada para tratar el sarcoma de Kaposi. El recubrimiento de polietilenglicol da como resultado una concentración preferencial de doxorrubicina en la piel. Sin embargo, esto también resulta en un efecto secundario llamado eritrodisestesia plantar palmar (PPE), más comúnmente conocido como síndrome mano-pie.
Después de la administración de esta forma de doxorrubicina, pequeñas cantidades del fármaco pueden filtrarse por los capilares de las palmas de las manos y las plantas de los pies. El resultado de esta fuga es enrojecimiento, sensibilidad y descamación de la piel que puede ser incómodo e incluso doloroso. En las pruebas clínicas en dosis de 50 mg / m 2 cada 4 semanas, la mitad de las personas desarrollaron el síndrome mano-pie. La tasa de este efecto secundario limita la dosis de esta formulación que se puede administrar en comparación con la doxorrubicina simple en el mismo régimen de tratamiento, lo que limita la posible sustitución. La sustitución sería deseable porque la doxorrubicina encapsulada en liposomas es menos cardiotóxica que la doxorrubicina no encapsulada. Esta forma encapsulada en liposomas también está aprobada por la FDA para el tratamiento del cáncer de ovario y el mieloma múltiple.
Una doxorrubicina liposomal no pegilada, llamada Myocet, está aprobada en la Unión Europea y en Canadá para el tratamiento del cáncer de mama metastásico en combinación con ciclofosfamida , pero la FDA no ha aprobado su uso en los Estados Unidos. A diferencia de Doxil, el liposoma Myocet no tiene un recubrimiento de polietilenglicol y, por lo tanto, no produce la misma tasa de EPP. La minimización de este efecto secundario puede permitir la sustitución uno por uno (1: 1) con doxorrubicina en el mismo régimen de tratamiento, mejorando así la seguridad sin pérdida de eficacia. Como Doxil, la encapsulación liposomal de la doxorrubicina limita la cardiotoxicidad. En teoría, al limitar la cardiotoxicidad de la doxorrubicina a través de la encapsulación liposomal, se puede utilizar de forma segura en combinación con otros fármacos de quimioterapia cardiotóxica, como trastuzumab . Hay una advertencia de recuadro negro de la FDA de que el trastuzumab no se puede usar en combinación con la doxorrubicina, solo en combinación secuencial. Aunque la combinación concurrente de trastuzumab y doxorrubicina en estudios clínicos encontró una respuesta tumoral superior, la combinación resultó en una cardiotoxicidad inaceptable, incluido el riesgo de insuficiencia cardíaca que se manifiesta como insuficiencia cardíaca congestiva (ICC). Los resultados publicados del estudio de fase II han demostrado que Myocet, trastuzumab y paclitaxel se pueden utilizar de forma segura y simultánea sin el riesgo cardíaco, medido por la reducción de la función de la FEVI , sin dejar de lograr una respuesta tumoral superior. Este hallazgo es la base del ensayo de fase III en curso para la aprobación de la FDA.
Biosíntesis
La doxorrubicina (DXR) es una versión 14- hidroxilada de daunorrubicina , el precursor inmediato de DXR en su vía biosintética .
La daunorrubicina se encuentra más abundantemente como producto natural porque es producida por una serie de diferentes cepas de Streptomyces de tipo salvaje . En contraste, se encontró inicialmente que sólo una especie conocida de tipo no salvaje , Streptomyces peucetius subespecie cesius ATCC 27952, era capaz de producir la doxorrubicina más ampliamente utilizada. Esta cepa fue creada por Arcamone et al. en 1969 mediante la mutación de una cepa que produce daunorrubicina, pero no DXR, al menos en cantidades detectables. Posteriormente, el grupo de Hutchinson demostró que en condiciones ambientales especiales, o mediante la introducción de modificaciones genéticas , otras cepas de Streptomyces pueden producir doxorrubicina. Su grupo también clonó muchos de los genes necesarios para la producción de DXR, aunque no todos se han caracterizado por completo. En 1996, el grupo de Strohl descubrió, aisló y caracterizó dox A, el gen que codifica la enzima que convierte la daunorrubicina en DXR.
En 1999, produjeron dox A recombinante, una oxidasa del citocromo P450 , y descubrieron que cataliza múltiples pasos en la biosíntesis de DXR , incluidos los pasos que conducen a la daunorrubicina. Esto fue significativo porque quedó claro que todas las cepas productoras de daunorrubicina tienen los genes necesarios para producir DXR, el mucho más importante desde el punto de vista terapéutico de los dos. El grupo de Hutchinson pasó a desarrollar métodos para mejorar el rendimiento de DXR, a partir del proceso de fermentación utilizado en su producción comercial, no solo mediante la introducción de plásmidos que codifican dox A , sino también mediante la introducción de mutaciones para desactivar enzimas que desvían los precursores de DXR a productos menos útiles. por ejemplo, glucósidos de tipo baumicina . Algunos mutantes triples, que también sobreexpresaron dox A, pudieron duplicar el rendimiento de DXR. Esto tiene un interés más que académico, porque en ese momento DXR costaba alrededor de $ 1,37 millones por kg y la producción actual en 1999 era de 225 kg por año.
Las técnicas de producción más eficientes han reducido el precio a 1,1 millones de dólares por kg para la formulación no liposomal . Aunque DXR se puede producir semisintéticamente a partir de daunorrubicina, el proceso implica bromación electrofílica y múltiples pasos, y el rendimiento es bajo. Dado que la daunorrubicina se produce por fermentación , sería ideal si las bacterias pudieran completar la síntesis de DXR de manera más efectiva.
Mecanismo de acción
La doxorrubicina interactúa con el ADN por intercalación e inhibición de la biosíntesis macromolecular . Esto inhibe la progresión de la topoisomerasa II , una enzima que relaja los superenrollamientos del ADN para la transcripción . La doxorrubicina estabiliza el complejo de topoisomerasa II después de que ha roto la cadena de ADN para la replicación, evitando que se libere la doble hélice de ADN y deteniendo así el proceso de replicación . También puede aumentar la producción de radicales libres de tipo quinona, contribuyendo así a su citotoxicidad.
La porción cromóforo aromático planar de la molécula se intercala entre dos pares de bases del ADN, mientras que el azúcar daunosamina de seis miembros se encuentra en el surco menor e interactúa con los pares de bases flanqueantes inmediatamente adyacentes al sitio de intercalación, como lo demuestran varias estructuras cristalinas.
Por intercalación , la doxorrubicina también puede inducir el desalojo de histonas de la cromatina transcripcionalmente activa . Como resultado, la respuesta al daño del ADN , el epigenoma y el transcriptoma están desregulados en las células expuestas a la doxorrubicina.
Historia
En la década de 1950, una empresa de investigación italiana, Farmitalia Research Laboratories, inició un esfuerzo organizado para encontrar compuestos anticancerígenos a partir de microbios del suelo. Se aisló una muestra de suelo del entorno del Castel del Monte , un castillo del siglo XIII. Se aisló una nueva cepa de Streptomyces peucetius , que producía un pigmento rojo, y un antibiótico de esta bacteria fue eficaz contra los tumores en ratones. Dado que un grupo de investigadores franceses descubrió el mismo compuesto aproximadamente al mismo tiempo, los dos equipos nombraron al compuesto daunorrubicina , combinando el nombre Dauni , una tribu prerromana que ocupaba el área de Italia donde estaba aislado el compuesto, con la palabra francesa para rubí , rubis , describiendo el color. Los ensayos clínicos comenzaron en la década de 1960 y el fármaco tuvo éxito en el tratamiento de la leucemia aguda y el linfoma. Sin embargo, en 1967, se reconoció que la daunorrubicina podía provocar una toxicidad cardíaca mortal.
Los investigadores de Farmitalia pronto descubrieron que los cambios en la actividad biológica podrían producirse mediante cambios menores en la estructura del compuesto. Una cepa de Streptomyces se mutó usando N -nitroso- N -metil uretano, y esta nueva cepa produce una diferente, antibiótico de color rojo. Llamaron a este nuevo compuesto Adriamicina, en honor al Mar Adriático , y luego el nombre se cambió a doxorrubicina para ajustarse a la convención de nomenclatura establecida. La doxorrubicina mostró una mejor actividad que la daunorrubicina contra los tumores de ratón, y especialmente los tumores sólidos. También mostró un índice terapéutico más alto , sin embargo, se mantuvo la cardiotoxicidad .
La doxorrubicina y la daunorrubicina juntas pueden considerarse como compuestos prototipo de las antraciclinas . La investigación posterior ha llevado a muchos otros antibióticos de antraciclina, o análogos, y ahora hay más de 2000 análogos conocidos de doxorrubicina. En 1991, 553 de ellos habían sido evaluados en el programa de detección del Instituto Nacional del Cáncer (NCI). En 2016, la FDA de EE. UU. Le otorgó la designación de fármaco huérfano al GPX-150 .
sociedad y Cultura
Nombres
También se conoce como hidroxidaunorrubicina e hidroxidaunomicina.
Se vende bajo varias marcas diferentes, que incluyen Adriamycin PFS, Adriamycin RDF o Rubex.
Formulaciones
La doxorrubicina es fotosensible y los recipientes a menudo se cubren con una bolsa de aluminio y / o papel encerado marrón para evitar que la luz los afecte. La doxorrubicina también está disponible en formas encapsuladas en liposomas como Doxil ( forma pegilada ), Myocet (forma no pegilada) y Caelyx, que también se administran por inyección intravenosa.
Escasez
Entre 2011 y marzo de 2014, Doxil tuvo una oferta limitada. En 2011, Doxil estuvo disponible solo en un suministro muy limitado debido a problemas de producción con el fabricante externo. Johnson & Johnson (JNJ), a través de su subsidiaria Janssen Products, LP, había estado recibiendo su suministro de Doxil del fabricante contratado Ben Venue Laboratories (ubicado en Bedford, Ohio), una unidad de Boehringer Ingelheim GmbH de Alemania. Los problemas comenzaron cuando Ben Venue cerró temporalmente sus instalaciones de fabricación debido a problemas de control de calidad.
En febrero de 2012, para abordar la escasez de Doxil, la Administración de Alimentos y Medicamentos de los EE. UU. (FDA) permitió la importación temporal de Lipodox, que contiene el mismo ingrediente activo que Doxil y está fabricado por Sun Pharma Global FZE (Sun), una subsidiaria de Sun Pharmaceutical Industries Ltd. de India. La agencia dijo que tenía la intención de continuar permitiendo la importación de Lipodox hasta que Sun haya fabricado suficiente Doxil genérico para satisfacer la demanda.
La FDA aprobó la primera versión genérica de Doxil, fabricada por Sun, en febrero de 2013. Estará disponible en viales de 20 miligramos y 50 miligramos.
Investigar
Los experimentos de terapia combinada con sirolimus (rapamicina) y doxorrubicina se han mostrado prometedores en el tratamiento de linfomas positivos para Akt en ratones.
En 2006, la investigación con animales que combinó un anticuerpo monoclonal murino con doxorrubicina creó un inmunoconjugado que pudo eliminar la infección por VIH-1 en ratones. El tratamiento con terapia antirretroviral (ART) deja focos de VIH dentro del huésped. El inmunoconjugado podría proporcionar potencialmente un tratamiento adyuvante al ART para erradicar las células T que expresan antígenos .
Actividad antipalúdica
Existe alguna evidencia de actividad antipalúdica de la doxorrubicina y compuestos similares. En 2009, se descubrió que un compuesto de estructura similar a la doxorrubicina inhibe la plasmepsina II, una enzima exclusiva del parásito de la malaria Plasmodium falciparum . La compañía farmacéutica GlaxoSmithKline (GSK) identificó posteriormente la doxorrubicina en un conjunto de compuestos que inhiben el crecimiento de parásitos.
Fluorescencia
También se sabe que la doxorrubicina es fluorescente. Esto se ha utilizado a menudo para caracterizar las concentraciones de doxorrubicina y ha abierto la posibilidad de utilizar la molécula como agente teranóstico . Sin embargo, existen limitaciones significativas, ya que se sabe que el espectro de fluorescencia de la doxorrubicina depende de una variedad de factores, incluido el pH del ambiente, la constante dieléctrica del solvente y otros. La fluorescencia de la doxorrubicina se apaga al unirse al ADN y se protege mediante la encapsulación de micelas. También se sabe que se apaga automáticamente a altas concentraciones. Por el contrario, la unión de histonas amplifica la fluorescencia.
Ver también
Referencias
enlaces externos
-
 Medios relacionados con la doxorrubicina en Wikimedia Commons
Medios relacionados con la doxorrubicina en Wikimedia Commons - "Doxorrubicina" . Portal de información sobre medicamentos . Biblioteca Nacional de Medicina de EE. UU.

