Oligosacaryltransferasa - Oligosaccharyltransferase
| STT3 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
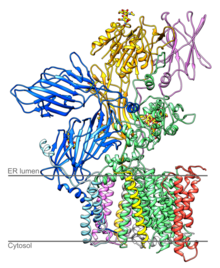 Estructura de la levadura OST
| |||||||||
| Identificadores | |||||||||
| Símbolo | STT3 | ||||||||
| Pfam | PF02516 | ||||||||
| Clan pfam | CL0111 | ||||||||
| InterPro | IPR003674 | ||||||||
| Superfamilia OPM | 242 | ||||||||
| Proteína OPM | 3rce | ||||||||
| CAZy | GT66 | ||||||||
| Membranome | 275 | ||||||||
| |||||||||
La oligosacariltransferasa o OST ( EC 2.4.1.119 ) es un complejo de proteína de membrana que transfiere un oligosacárido de 14 azúcares del dolicol a la proteína naciente . Es un tipo de glicosiltransferasa . El azúcar Glc 3 Man 9 GlcNAc 2 (donde Glc = glucosa , Man = manosa y GlcNAc = N -acetilglucosamina ) se une a un residuo de asparagina (Asn) en la secuencia Asn-X- Ser o Asn-X- Thr donde X es cualquier aminoácido excepto prolina . Esta secuencia se llama una glicosilación sequon . La reacción catalizada por OST es el paso central en la vía de glicosilación N- enlazada .
Localización

OST es un componente de la translocon en el retículo endoplasmático (ER) de la membrana . Un núcleo-oligosacárido ligado a lípidos se ensambla en la membrana del retículo endoplásmico y se transfiere a restos de asparagina seleccionados de cadenas polipeptídicas nacientes mediante el complejo oligosacaril transferasa . El sitio activo de la OST se encuentra a unos 4 nm de la cara lumenal de la membrana del RE.
Por lo general, actúa durante la traducción cuando la proteína naciente ingresa al RE, pero esta glicosilación cotraduccional se denomina, no obstante, modificación postraduccional . Se han encontrado algunos ejemplos de actividad OST una vez completada la traducción. La opinión actual es que la actividad postraduccional puede ocurrir si la proteína está mal plegada o se pliega lentamente.
Estructura y función
La levadura OST se compone de ocho proteínas diferentes que atraviesan la membrana en tres subcomplejos (uno de ellos es OST4 ). Estos octómeros no forman oligómeros de orden superior y tres de las ocho proteínas están glicosiladas. Se sabe que la OST en mamíferos tiene una composición similar.
Se cree que OST requiere muchas subunidades porque debe:
- Se coloca cerca del poro translocón.
- Reconocer y unir oligosaccharyldolichol.
- Escanee la proteína naciente para reconocer y unir lentejuelas.
- Mueva estos dos sustratos grandes a sus ubicaciones y conformaciones adecuadas.
- Active el átomo de nitrógeno de la amida Asn para la transferencia real de oligosacárido.
- Libera sus sustratos.
La subunidad catalíticamente activa de la OST se llama STT3. Existen dos parálogos en eucariotas, denominados STT3A y STT3B . STT3A es principalmente responsable de la glicosilación cotraduccional del polipéptido naciente cuando entra en el lumen del retículo endoplásmico, mientras que STT3B también puede mediar la glicosilación postraduccional. Se ha resuelto la estructura de PglB , el homólogo procariótico de STT3. La gran similitud de secuencia entre el STT3 procariota y eucariota sugiere que sus estructuras son similares.
Significación clínica
Los síndromes de CDG son trastornos genéticos de la vía de glicosilación. Están etiquetados como "Tipo I" si el gen defectuoso es para una enzima involucrada en el ensamblaje o transferencia del precursor Glc 3 Man 9 GlcNAc 2 -dolicol. Se etiquetan "Tipo II" si el paso defectuoso se produce después de la acción de OST en el N -vinculada glicosilación vía o involucra O -vinculada glicosilación .
Ver también
Referencias
enlaces externos
- oligosacaryltransferase en los encabezados de temas médicos (MeSH) de la Biblioteca Nacional de Medicina de EE. UU .
