Neuropsicofarmacología - Neuropsychopharmacology
La neuropsicofarmacología , una ciencia interdisciplinaria relacionada con la psicofarmacología (cómo las drogas afectan la mente) y la neurociencia fundamental , es el estudio de los mecanismos neuronales sobre los que actúan las drogas para influir en el comportamiento. Implica la investigación de los mecanismos de la neuropatología , la farmacodinamia (acción de los fármacos) , las enfermedades psiquiátricas y los estados de conciencia . Estos estudios se promueven a un nivel detallado que involucra la actividad de neurotransmisión / receptor , procesos bioquímicos y circuitos neuronales . La neuropsicofarmacología reemplaza a la psicofarmacología en las áreas de "cómo" y "por qué", y además aborda otras cuestiones de la función cerebral. En consecuencia, el aspecto clínico del campo incluye tratamientos basados en farmacología psiquiátrica (psicoactiva) y neurológica (no psicoactiva). Los avances en Neuropsicofarmacología pueden afectar directamente a los estudios de los trastornos de ansiedad , trastornos afectivos , trastornos psicóticos , trastornos degenerativos , conducta alimentaria , y del comportamiento del sueño .
Historia
Los seres humanos han utilizado durante milenios drogas como el opio , el alcohol y ciertas plantas para aliviar el sufrimiento o cambiar la conciencia, pero hasta la era científica moderna, el conocimiento de cómo funcionaban realmente las sustancias era bastante limitado, y la mayor parte del conocimiento farmacológico era más una serie de observaciones. que un modelo coherente. La primera mitad del siglo XX consideró a la psicología y la psiquiatría como en gran medida fenomenológicas , en el sentido de que los comportamientos o temas que se observaron en los pacientes a menudo podían correlacionarse con una variedad limitada de factores, como la experiencia de la infancia, tendencias heredadas o lesiones en áreas específicas del cerebro. Los modelos de función y disfunción mental se basaron en tales observaciones. De hecho, la rama conductual de la psicología prescindió por completo de lo que realmente sucedió dentro del cerebro, considerando la mayoría de las disfunciones mentales como lo que podría denominarse errores de "software". En la misma época, el sistema nervioso se estaba estudiando progresivamente a nivel microscópico y químico, pero prácticamente no había beneficio mutuo con los campos clínicos, hasta que varios desarrollos posteriores a la Segunda Guerra Mundial comenzaron a unirlos. Se puede considerar que la neuropsicofarmacología comenzó a principios de la década de 1950 con el descubrimiento de fármacos como los inhibidores de la MAO , los antidepresivos tricíclicos , la torazina y el litio, que mostraron cierta especificidad clínica para enfermedades mentales como la depresión y la esquizofrenia. Hasta ese momento, los tratamientos que realmente se dirigían a estas complejas enfermedades eran prácticamente inexistentes. Los métodos destacados que podrían afectar directamente los circuitos cerebrales y los niveles de neurotransmisores fueron la lobotomía prefrontal y la terapia electroconvulsiva , la última de las cuales se llevó a cabo sin relajantes musculares y ambas causaron a menudo al paciente una gran lesión física y psicológica.
El campo ahora conocido como neuropsicofarmacología ha sido el resultado del crecimiento y la extensión de muchos campos previamente aislados que se han reunido en el núcleo de la medicina psiquiátrica, y involucra a una amplia gama de profesionales, desde psiquiatras hasta investigadores en genética y química. El uso del término ha ganado popularidad desde 1990 con la fundación de varias revistas e instituciones como el Colegio Húngaro de Neuropsicofarmacología . Este campo de rápida maduración muestra cierto grado de cambio, ya que las hipótesis de investigación a menudo se reestructuran sobre la base de nueva información.
Visión general
Una premisa implícita en la neuropsicofarmacología con respecto a los aspectos psicológicos es que todos los estados mentales , incluidos los estados alterados tanto normales como inducidos por drogas, y las enfermedades que involucran disfunción mental o cognitiva , tienen una base neuroquímica a nivel fundamental, y ciertas vías de circuito en el sistema nervioso central a un nivel superior. (Ver también: doctrina de las neuronas ) Por lo tanto, la comprensión de las células nerviosas o neuronas del cerebro es fundamental para comprender la mente. Se razona que los mecanismos implicados pueden dilucidarse mediante métodos clínicos y de investigación modernos, como la manipulación genética en sujetos animales, técnicas de imagen como la resonancia magnética funcional ( fMRI ) y estudios in vitro utilizando agentes aglutinantes selectivos en cultivos de tejidos vivos. Estos permiten monitorear y medir la actividad neuronal en respuesta a una variedad de condiciones de prueba. Otras herramientas de observación importantes incluyen la obtención de imágenes radiológicas , como la tomografía por emisión de positrones ( PET ) y la tomografía computarizada por emisión de fotón único ( SPECT ). Estas técnicas de imagen son la imagen lata extremadamente sensible y concentraciones moleculares pequeños del orden de 10 -10 M tal como se encuentra con extrastriatal D 1 receptor de la dopamina.
Uno de los objetivos finales es diseñar y desarrollar recetas de tratamiento para una variedad de condiciones neuropatológicas y trastornos psiquiátricos . Sin embargo, de manera más profunda, el conocimiento adquirido puede proporcionar información sobre la naturaleza misma del pensamiento humano, las habilidades mentales como el aprendizaje y la memoria, y quizás la conciencia misma. Un producto directo de la investigación neuropsicofarmacológica es la base de conocimientos necesaria para desarrollar fármacos que actúen sobre receptores muy específicos dentro de un sistema de neurotransmisores. Estos fármacos de "acción hiperselectiva" permitirían el direccionamiento directo de sitios específicos de actividad neural relevante, maximizando así la eficacia (o técnicamente la potencia ) del fármaco dentro del objetivo clínico y minimizando los efectos adversos . Sin embargo, hay algunos casos en los que algún grado de promiscuidad farmacológica es tolerable e incluso deseable, produciendo resultados más deseables que los que produciría un agente más selectivo. Un ejemplo de esto es la vortioxetina , un fármaco que no es particularmente selectivo como inhibidor de la recaptación de serotonina, que tiene un grado significativo de actividad moduladora de la serotonina, pero que ha demostrado una reducción de los síntomas de interrupción (y una menor probabilidad de recaída ) y una incidencia muy reducida de disfunción sexual. , sin pérdida de eficacia antidepresiva.
Actualmente se están preparando las bases para la próxima generación de tratamientos farmacológicos , que mejorarán la calidad de vida con una eficiencia cada vez mayor. Por ejemplo, contrariamente a lo que se pensaba anteriormente, ahora se sabe que el cerebro adulto desarrolla en cierta medida nuevas neuronas , cuyo estudio, además de los factores neurotróficos , puede albergar esperanzas para enfermedades neurodegenerativas como el Alzheimer , el Parkinson , la ELA y tipos. de corea . Todas las proteínas implicadas en la neurotransmisión son una pequeña fracción de las más de 100.000 proteínas del cerebro. Por tanto, hay muchas proteínas que ni siquiera se encuentran en el camino directo de la transducción de señales , cualquiera de las cuales puede seguir siendo un objetivo para una terapia específica. En la actualidad, se informa de nuevos enfoques farmacológicos para enfermedades o afecciones a un ritmo de casi uno por semana.
Neurotransmisión
Hasta donde sabemos, todo lo que percibimos, sentimos, pensamos, sabemos y hacemos es el resultado de las neuronas que se activan y reajustan. Cuando una célula del cerebro se dispara, pequeños cambios químicos y eléctricos llamados potencial de acción pueden afectar la activación de hasta mil neuronas más en un proceso llamado neurotransmisión . De esta manera, las señales se generan y se transportan a través de redes de neuronas, cuyo efecto eléctrico general se puede medir directamente en el cuero cabelludo mediante un dispositivo de electroencefalograma .
En la última década del siglo XX, se había adquirido el conocimiento esencial de todas las características centrales de la neurotransmisión. Estas características son:
- La síntesis y almacenamiento de sustancias neurotransmisoras ,
- El transporte de vesículas sinápticas y su posterior liberación a la sinapsis ,
- Activación del receptor y función en cascada ,
- Mecanismos de transporte (recaptación) y / o degradación enzimática
Los avances más recientes involucran la comprensión a nivel molecular orgánico ; acción bioquímica de los ligandos endógenos , enzimas , proteínas receptoras , etc. Los cambios críticos que afectan la activación celular ocurren cuando los neurotransmisores de señalización de una neurona, actuando como ligandos, se unen a los receptores de otra neurona. Muchos sistemas y receptores de neurotransmisores son bien conocidos y la investigación continúa hacia la identificación y caracterización de un gran número de subtipos de receptores muy específicos. Para los seis neurotransmisores más importantes Glu , GABA , Ach , NE , DA y 5HT (enumerados en neurotransmisor ) existen al menos 29 subtipos principales de receptor. Existen más "sub-subtipos" junto con variantes, por un total de cientos para estos 6 transmisores. - (ver receptor de serotonina, por ejemplo). A menudo se encuentra que los subtipos de receptores tienen una función diferenciada, lo que en principio abre la posibilidad de un control intencional refinado sobre la función cerebral.
Anteriormente se sabía que el control final sobre el voltaje o potencial de la membrana de una célula nerviosa, y por lo tanto la activación de la célula, reside en los canales iónicos transmembrana que controlan las corrientes de la membrana a través de los iones K + , Na + y Ca +. + , y de menor importancia Mg ++ y Cl - . Las diferencias de concentración entre el interior y el exterior de la celda determinan el voltaje de la membrana.
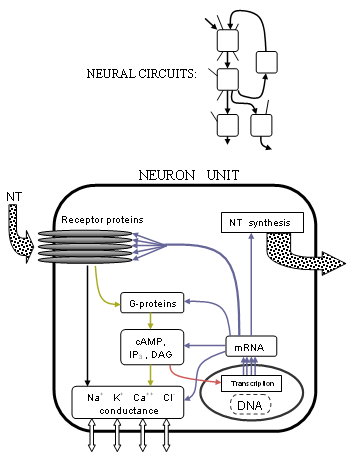
Precisamente cómo se controlan estas corrientes se ha vuelto mucho más claro con los avances en la estructura del receptor y los procesos acoplados a la proteína G. Se ha descubierto que muchos receptores son agrupaciones pentaméricas de cinco proteínas transmembrana (no necesariamente iguales) o subunidades receptoras , cada una de las cuales es una cadena de muchos aminoácidos. Los transmisores típicamente se unen en la unión entre dos de estas proteínas, en las partes que sobresalen de la membrana celular. Si el receptor es de tipo ionotrópico , un poro o canal central en el medio de las proteínas se moverá mecánicamente para permitir que fluyan ciertos iones, alterando así la diferencia de concentración de iones. Si el receptor es de tipo metabotrópico , las proteínas G causarán un metabolismo dentro de la célula que eventualmente puede cambiar otros canales iónicos. Los investigadores comprenden mejor con precisión cómo se producen estos cambios en función de las formas de la estructura de las proteínas y las propiedades químicas.
El alcance de esta actividad se ha ampliado aún más hasta el mismo plano de la vida desde la aclaración del mecanismo subyacente a la transcripción de genes . La síntesis de proteínas celulares a partir del ADN nuclear tiene la misma maquinaria fundamental para todas las células; cuya exploración tiene ahora una base firme gracias al Proyecto del Genoma Humano, que ha enumerado la secuencia completa del ADN humano, aunque quedan por identificar muchos de los 35.000 genes estimados. El proceso completo de neurotransmisión se extiende al nivel genético. La expresión génica determina las estructuras de las proteínas a través de la ARN polimerasa de tipo II . Por lo tanto, las enzimas que sintetizan o descomponen neurotransmisores, receptores y canales iónicos se elaboran a partir de ARNm a través de la transcripción del ADN de sus respectivos genes. Pero la neurotransmisión, además de controlar los canales iónicos, ya sea directamente o de otro modo a través de procesos metabotrópicos , también modula la expresión génica. Esto se logra de manera más prominente mediante la modificación del proceso de inicio de la transcripción mediante una variedad de factores de transcripción producidos a partir de la actividad del receptor.
Aparte de las importantes posibilidades farmacológicas de las vías de expresión génica, la correspondencia de un gen con su proteína permite la importante herramienta analítica del gen knockout . Se pueden crear muestras vivas mediante recombinación homóloga en la que no se puede expresar un gen específico. El organismo será entonces deficiente en la proteína asociada que puede ser un receptor específico. Este método evita el bloqueo químico que puede producir efectos secundarios confusos o ambiguos, por lo que los efectos de la falta de receptor se pueden estudiar en un sentido más puro.
Drogas
El inicio de muchas clases de fármacos es, en principio, sencillo: cualquier producto químico que pueda potenciar o disminuir la acción de una proteína diana podría investigarse más a fondo para tal uso. El truco consiste en encontrar una sustancia química que sea específica para el receptor (cf. " droga sucia ") y segura para consumir. El Physicians 'Desk Reference de 2005 enumera el doble de medicamentos recetados que la versión de 1990. Muchas personas ya están familiarizadas con los " inhibidores selectivos de la recaptación de serotonina ", o ISRS que ejemplifican los productos farmacéuticos modernos . Estos fármacos antidepresivos ISRS , como Paxil y Prozac, inhiben de forma selectiva y, por tanto, principalmente el transporte de serotonina, lo que prolonga la actividad en la sinapsis. Existen numerosas categorías de fármacos selectivos y el bloqueo del transporte es solo un modo de acción. La FDA ha aprobado medicamentos que actúan selectivamente sobre cada uno de los principales neurotransmisores, como los antidepresivos inhibidores de la recaptación de NE , los antipsicóticos bloqueadores de DA y los tranquilizantes agonistas de GABA ( benzodiazepinas ).
Continuamente se identifican nuevos productos químicos endógenos. Se han encontrado receptores específicos para los fármacos THC (cannabis) y GHB , con transmisores endógenos anandamida y GHB. Otro gran descubrimiento reciente ocurrió en 1999 cuando se descubrió que la orexina , o hipocretina, tenía un papel en la excitación, ya que la falta de receptores de orexina refleja la condición de la narcolepsia . El agonismo de la orexina puede explicar la acción antinarcoléptica del fármaco modafinilo, que ya se usaba solo un año antes.
El siguiente paso, en el que las principales compañías farmacéuticas están trabajando arduamente para desarrollar, son los medicamentos específicos de subtipo de receptor y otros agentes específicos. Un ejemplo es el impulso de mejores agentes ansiolíticos ( ansiolíticos ) basados en agonistas de GABA A (α2), antagonistas de CRF 1 y antagonistas de 5HT 2c . Otro es la propuesta de nuevas vías de exploración de antipsicóticos como los inhibidores de la recaptación de glicina . Aunque existen capacidades para fármacos específicos para receptores, una deficiencia de la farmacoterapia es la falta de capacidad para proporcionar especificidad anatómica . Al alterar la función del receptor en una parte del cerebro, se puede inducir una actividad anormal en otras partes del cerebro debido al mismo tipo de cambios en el receptor. Un ejemplo común es el efecto de los fármacos que alteran la D 2 (neurolépticos) que pueden ayudar a la esquizofrenia, pero que causan una variedad de discinesias por su acción sobre la corteza motora.
Los estudios modernos están revelando detalles de los mecanismos de daño al sistema nervioso, como la apoptosis (muerte celular programada) y la alteración de los radicales libres . Se ha descubierto que la fenciclidina causa muerte celular en las células estriatopallidales y vacuolización anormal en el hipocampo y otras neuronas. El trastorno de percepción persistente por alucinógenos (HPPD), también conocido como trastorno de percepción pospsicodélico , se ha observado en pacientes hasta 26 años después del uso de LSD. La causa plausible de HPPD es el daño al circuito inhibidor de GABA en la vía visual (los agonistas de GABA como el midazolam pueden disminuir algunos efectos de la intoxicación por LSD). El daño puede ser el resultado de una respuesta excitotóxica de las interneuronas 5HT 2 . [Nota: la gran mayoría de los usuarios de LSD no experimentan HPPD. Su manifestación puede depender tanto de la química cerebral individual como del uso de la droga en sí.] En cuanto a la MDMA , además de las pérdidas persistentes de 5HT y SERT , se encuentra una reducción duradera de los axones y terminales serotoninérgicos por el uso a corto plazo y el recrecimiento puede ser de función comprometida.
Circuitos neuronales
Es un descubrimiento no tan reciente que muchas funciones del cerebro están algo localizadas en áreas asociadas como la capacidad motora y del habla. Las asociaciones funcionales de la anatomía del cerebro ahora se complementan con correlatos clínicos, conductuales y genéticos de la acción del receptor, completando el conocimiento de la señalización neural (ver también: Proyecto Cognoma Humano ) . Las rutas de señales de las neuronas están hiperorganizadas más allá de la escala celular en rutas de circuitos neuronales a menudo complejas. El conocimiento de estas vías es quizás el más fácil de interpretar, siendo más reconocible desde el punto de vista del análisis de sistemas, como puede verse en los siguientes resúmenes.
Se ha encontrado que casi todas las drogas con un potencial conocido de abuso modulan la actividad (directa o indirectamente) en el sistema de dopamina mesolímbico, que incluye y conecta el área tegmental ventral en el mesencéfalo con el hipocampo, la corteza prefrontal medial y la amígdala en el prosencéfalo. ; así como el núcleo accumbens en el estriado ventral de los ganglios basales. En particular, el núcleo accumbens (NAc) juega un papel importante en la integración de la memoria experiencial del hipocampo, la emoción de la amígdala y la información contextual del PFC para ayudar a asociar estímulos o comportamientos particulares con sentimientos de placer y recompensa; La activación continua de este sistema indicador de recompensa por una droga adictiva también puede hacer que los estímulos previamente neutrales se codifiquen como señales de que el cerebro está a punto de recibir una recompensa. Esto sucede a través de la liberación selectiva de dopamina, un neurotransmisor responsable de las sensaciones de euforia y placer. El uso de fármacos dopaminérgicos altera la cantidad de dopamina liberada en todo el sistema mesolímbico, y el uso regular o excesivo del fármaco puede provocar una regulación a la baja a largo plazo de la señalización de la dopamina, incluso después de que un individuo deja de ingerir el fármaco. Esto puede llevar al individuo a involucrarse en conductas de búsqueda de drogas leves a extremas a medida que el cerebro comienza a esperar regularmente el aumento de la presencia de dopamina y los sentimientos de euforia que la acompañan, pero qué tan problemático sea esto depende en gran medida de la droga y la situación.
Se ha logrado un progreso significativo en los mecanismos centrales de ciertas drogas alucinógenas . En este punto se sabe con relativa certeza que los principales efectos compartidos de un amplio grupo farmacológico de alucinógenos, a veces llamados "psicodélicos clásicos", pueden atribuirse en gran parte al agonismo de los receptores de serotonina. El receptor 5HT 2A , que parece ser el receptor más crítico para la actividad psicodélica, y el receptor 5HT 2C , que es un objetivo importante de la mayoría de los psicodélicos pero que no tiene un papel claro en la alucinógeno, están involucrados liberando glutamato en la corteza frontal . mientras que simultáneamente en el locus coeruleus se promueve la información sensorial y disminuye la actividad espontánea. La actividad 5HT 2A tiene un efecto prodopaminérgico neto, mientras que el agonismo del receptor 5HT 2C tiene un efecto inhibidor sobre la actividad dopaminérgica, particularmente en la corteza prefrontal. Una hipótesis sugiere que en la corteza frontal, el 5HT 2A promueve potenciales postsinápticos excitadores asincrónicos tardíos , un proceso antagonizado por la serotonina misma a través de los receptores 5HT 1 , lo que puede explicar por qué los ISRS y otros fármacos que afectan a la serotonina normalmente no provocan alucinaciones en el paciente. Sin embargo, el hecho de que muchos psicodélicos clásicos de hecho tengan una afinidad significativa por los receptores 5HT 1 pone en duda esta afirmación. La respuesta de contracción de la cabeza, una prueba utilizada para evaluar la actividad psicodélica clásica en roedores, es producida por la serotonina misma solo en presencia de beta-Arrestins, pero es desencadenada por psicodélicos clásicos independientes del reclutamiento de beta-Arrestin. Esto puede explicar mejor la diferencia entre la farmacología de la neurotransmisión serotoninérgica (incluso si es promovida por fármacos como los ISRS) y la de los psicodélicos clásicos. Sin embargo, los hallazgos más recientes indican que la unión al heterodímero 5HT 2A - mGlu2 también es necesaria para la actividad psicodélica clásica. Esto también puede ser relevante para las diferencias farmacológicas entre los dos. Si bien al principio de la historia de la investigación de las drogas psicodélicas se asumió que estas alucinaciones eran comparables a las producidas por la psicosis y, por lo tanto, los psicodélicos clásicos podrían servir como modelo de psicosis, es importante señalar que el conocimiento neuropsicofarmacológico moderno de la psicosis ha progresado significativamente desde entonces, y ahora sabemos que la psicosis muestra poca similitud con los efectos de los psicodélicos clásicos en el mecanismo, la experiencia informada o la mayoría de los otros aspectos, aparte de la similitud superficial de la "alucinación".
El ritmo circadiano , o ciclo sueño / vigilia, se centra en el núcleo supraquiasmático (SCN) dentro del hipotálamo y está marcado por niveles de melatonina 2000 a 4000% más altos durante el sueño que durante el día. Se sabe que un circuito comienza con células de melanopsina en el ojo que estimulan el SCN a través de neuronas de glutamato del tracto hipotalámico . Las neuronas GABAérgicas del SCN inhiben el núcleo paraventricular , que envía señales al ganglio cervical superior (SCG) a través de fibras simpáticas . La salida del SCG estimula los receptores NE ( β ) en la glándula pineal que produce N-acetiltransferasa, lo que provoca la producción de melatonina a partir de la serotonina. Los receptores de melatonina inhibidores en el SCN proporcionan una vía de retroalimentación positiva . Por lo tanto, la luz inhibe la producción de melatonina que " arrastra " el ciclo de 24 horas de actividad del SCN. El SCN también recibe señales de otras partes del cerebro, y su ciclo (aproximadamente) de 24 horas no solo depende de los patrones de luz. De hecho, el tejido seccionado del SCN exhibirá un ciclo diario in vitro durante muchos días. Además, (no se muestra en el diagrama), el núcleo basal proporciona entrada inhibitoria GABA-ergica al hipotálamo anterior preóptico (PAH). Cuando la adenosina se acumula a partir del metabolismo del ATP a lo largo del día, se une a los receptores de adenosina e inhibe el núcleo basal. A continuación, se activa la PAH, lo que genera una actividad de sueño de onda lenta. Se sabe que la cafeína bloquea los receptores de adenosina, inhibiendo así el sueño, entre otras cosas.
Investigar
La investigación en el campo de la neuropsicofarmacología abarca una amplia gama de objetivos. Estos podrían incluir el estudio de un nuevo compuesto químico para efectos cognitivos o conductuales potencialmente beneficiosos, o el estudio de un compuesto químico antiguo para comprender mejor su mecanismo de acción a nivel celular y del circuito neuronal. Por ejemplo, se sabe desde hace mucho tiempo que la droga estimulante adictiva cocaína actúa sobre el sistema de recompensa en el cerebro, aumentando los niveles de dopamina y norepinefrina e induciendo euforia durante un corto período de tiempo. Sin embargo, estudios publicados más recientemente han ido más allá del nivel del circuito y encontraron que un complejo receptor acoplado a proteína G particular llamado A2AR-D2R-Sigma1R se forma en el NAc después del uso de cocaína; este complejo reduce la señalización de D2R en la vía mesolímbica y puede ser un factor que contribuya a la adicción a la cocaína. Otros estudios de vanguardia se han centrado en la genética para identificar biomarcadores específicos que pueden predecir las reacciones específicas de un individuo o el grado de respuesta a una droga o su tendencia a desarrollar adicciones en el futuro. Estos hallazgos son importantes porque brindan información detallada sobre los circuitos neuronales involucrados en el uso de drogas y ayudan a perfeccionar los métodos de tratamiento antiguos y nuevos para los trastornos o adicciones. Diferentes estudios relacionados con el tratamiento están investigando el papel potencial de los ácidos nucleicos peptídicos en el tratamiento de la enfermedad de Parkinson y la esquizofrenia, mientras que otros intentan establecer correlaciones neuronales previamente desconocidas que subyacen a ciertos fenómenos.
La investigación en neuropsicofarmacología proviene de una amplia gama de actividades en neurociencia e investigación clínica. Esto ha motivado a organizaciones como el Colegio Americano de Neuropsicofarmacología (ACNP) , el Colegio Europeo de Neuropsicofarmacología (ECNP) y el Collegium Internationale Neuro-psychopharmacologicum (CINP) a establecerse como una medida de enfoque. El ECNP publica European Neuropsychopharmacology , y como parte del Reed Elsevier Group , el ACNP publica la revista Neuropsychopharmacology , y el CINP publica la revista International Journal of Neuropsychopharmacology con Cambridge University Press . En 2002, se compiló un trabajo recopilado reciente y completo del ACNP, "Neuropsicofarmacología: la quinta generación del progreso". Es una medida del estado del conocimiento en 2002, y podría decirse que representa un hito en el objetivo de un siglo de establecer los principios neurobiológicos básicos que gobiernan las acciones del cerebro.
Existen muchas otras revistas que contienen información relevante como Neuroscience . Algunos de ellos están listados en la Biblioteca de la Universidad de Brown .
Ver también
Notas
Referencias
- ("4th Gen." y "5th Gen." se refieren a ACNP, ver enlaces)
- ^ "La historia de HCNP: intercambiar información y catalizar el progreso",ECNP Newsletter, N7 (2004)
- ^ Fujita, M. e Innis, RB, "Imágenes molecularesin vivo: aplicaciones de investigación y desarrollo de ligandos", (5th Gen. Prog.)
- ^ Tallman, JF,"Neuropsicofarmacología en el nuevo milenio: nuevas direcciones de la industria",Neuropsicofarmacología20 (1999)
- ^ Bloom, FE, "Introducción a la neuropsicofarmacología preclínica", (Prog. De cuarta generación).
- ^ Watson, SJ y Cullinan, WE, "Citología y circuitos", (Prog. 4ª generación)
- ^ Referencia de escritorio de médicos, 1990, 2005
- ^ Erowid,"La neurofarmacología del γ-hidroxibutirato (GHB)"(2004)
- ^ Tallman, JF, Cassella, J., Kehne, J., "Mecanismo de acción de los ansiolíticos", (5th Gen. Prog.)
- ^ Depoortère, R.,et al. , "Perfiles neuroquímicos, electrofisiológicos y farmacológicos del inhibidor selectivo del transportador de glicina-1 SSR504734, un nuevo tipo potencial de antipsicótico",Neuropsychopharmacology30, pp1963-1985, (2005)
- ^ Abraham, HD, Mccann, UD, Ricaurte, GA, "Drogas psicodélicas", (Prog. 5.ª generación)
- ^ Colwell, CS, "Ritmos circadianos", (Prog. 4.ª generación)
- ^ Lewy, AJ, "Trastornos del sueño y del estado de ánimo de la fase circadiana", (Prog. 5.ª generación)
enlaces externos
- Recursos de ACNP
- Organizaciones
- Collegium Internationale Neuro-psychopharmacologicum Una organización global dedicada a la neuropsicofarmacología
- Colegio Europeo de Neuropsicofarmacología
- Revistas
- Revista de Neuropsicofarmacología - Publicación oficial del Colegio Americano de Neuropsicofarmacología
- Neuropsicofarmacología europea : una revista de Elsevier
- The International Journal of Neuropsychopharmacology - Una publicación de Cambridge University Press
- Neuropsicofarmacología y terapéutica por Ivor Ebenezer (2015), John Wiley & Sons, Chichester, Reino Unido, ISBN 978-1-118-38565-4

