Hemozoína - Hemozoin
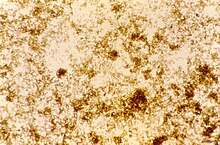
La hemozoína es un producto de eliminación formado a partir de la digestión de la sangre por algunos parásitos que se alimentan de sangre . Estos organismos hematófagos , como los parásitos de la malaria ( Plasmodium spp. ), Rhodnius y Schistosoma, digieren la hemoglobina y liberan grandes cantidades de hemo libre , que es el componente no proteico de la hemoglobina . El hemo es un grupo protésico que consta de un átomo de hierro contenido en el centro de un anillo de porfirina heterocíclico . El hemo libre es tóxico para las células, por lo que los parásitos lo convierten en una forma cristalina insoluble llamada hemozoína. En los parásitos de la malaria, la hemozoína a menudo se denomina pigmento de la malaria .
Dado que la formación de hemozoína es esencial para la supervivencia de estos parásitos, es un objetivo atractivo para el desarrollo de medicamentos y se ha estudiado mucho en Plasmodium como una forma de encontrar medicamentos para tratar la malaria ( talón de Aquiles de la malaria ). Se cree que varios fármacos antipalúdicos utilizados actualmente , como la cloroquina y la mefloquina , matan los parásitos de la malaria al inhibir la biocristalización de la hemozoína .
Descubrimiento
El pigmento negro-marrón fue observado por Johann Heinrich Meckel en 1847, en la sangre y el bazo de una persona que sufría de locura. Sin embargo, no fue hasta 1849 que la presencia de este pigmento se relacionó con la infección por malaria. Inicialmente, se pensó que el cuerpo producía este pigmento en respuesta a una infección, pero Charles Louis Alphonse Laveran se dio cuenta en 1880 de que el "pigmento de la malaria" es, en cambio, producido por los parásitos, ya que se multiplican dentro de los glóbulos rojos . El vínculo entre el pigmento y los parásitos de la malaria fue utilizado por Ronald Ross para identificar las etapas del ciclo de vida del Plasmodium que ocurren dentro del mosquito, ya que, aunque estas formas del parásito son diferentes en apariencia a las etapas sanguíneas, aún contienen trazas de pigmento. .
Más tarde, en 1891, T. Carbone y WH Brown (1911) publicaron artículos que vinculaban la degradación de la hemoglobina con la producción de pigmento, describiendo el pigmento de la malaria como una forma de hematina y refutando la idea generalizada de que está relacionada con la melanina . Brown observó que todas las melaninas se decoloran rápidamente con permanganato de potasio, mientras que con este reactivo el pigmento de la malaria no manifiesta el menor signo de una verdadera reacción de blanqueo. El nombre "hemozoína" fue propuesto por Louis Westenra Sambon . En la década de 1930, varios autores identificaron la hemozoína como una forma cristalina pura de α-hematina y demostraron que la sustancia no contenía proteínas dentro de los cristales, pero no se dio ninguna explicación de las diferencias de solubilidad entre el pigmento de la malaria y los cristales de α-hematina.
Formación
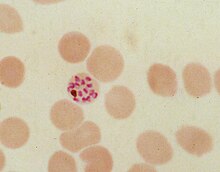
Durante su ciclo de reproducción asexual intraeritrocítica, Plasmodium falciparum consume hasta el 80% de la hemoglobina de la célula huésped . La digestión de la hemoglobina libera α-hematina monomérica ( ferriprotoporfirina IX). Este compuesto es tóxico, ya que es un prooxidante y cataliza la producción de especies reactivas de oxígeno . Se cree que el estrés oxidativo se genera durante la conversión de hem (ferroprotoporfirina) en hematina (ferriprotoporfirina). La hematina libre también puede unirse y alterar las membranas celulares , dañando las estructuras celulares y provocando la lisis del eritrocito del huésped. La reactividad única de esta molécula se ha demostrado en varias condiciones experimentales in vitro e in vivo .

El parásito de la malaria, por lo tanto, desintoxica la hematina, lo que hace por biocristalización , convirtiéndola en cristales de β-hematina insolubles y químicamente inertes (llamados hemozoína). En Plasmodium, la vacuola de los alimentos se llena de cristales de hemozoína, que tienen alrededor de 100-200 nanómetros de largo y cada uno contiene alrededor de 80.000 moléculas de hemo. La desintoxicación a través de la biocristalización es distinta del proceso de desintoxicación en los mamíferos, donde una enzima llamada hemo oxigenasa rompe el exceso de hemo en biliverdina , hierro y monóxido de carbono .
Se han propuesto varios mecanismos para la producción de hemozoína en Plasmodium , y el área es muy controvertida, y se proponen lípidos de membrana , proteínas ricas en histidina o incluso una combinación de las dos para catalizar la formación de hemozoína. Otros autores han descrito una proteína de desintoxicación hem, que se dice que es más potente que los lípidos o las proteínas ricas en histidina. Es posible que muchos procesos contribuyan a la formación de hemozoína. La formación de hemozoína en otros organismos que se alimentan de sangre no está tan bien estudiada como en Plasmodium . Sin embargo, los estudios sobre Schistosoma mansoni han revelado que este gusano parásito produce grandes cantidades de hemozoína durante su crecimiento en el torrente sanguíneo humano. Aunque las formas de los cristales son diferentes de las producidas por los parásitos de la malaria, el análisis químico del pigmento mostró que está hecho de hemozoína. De manera similar, los cristales formados en el intestino de la chinche Rhodnius prolixus durante la digestión de la sangre también tienen una forma única, pero están compuestos de hemozoína. La formación de Hz en el intestino medio de R. prolixus ocurre en condiciones fisicoquímicas fisiológicamente relevantes y los lípidos juegan un papel importante en la biocristalización del hemo. Se revela que la cristalización de hemo autocatalítica a Hz es un proceso ineficaz y esta conversión se reduce aún más a medida que aumenta la concentración de Hz.
Se han desarrollado varios otros mecanismos para proteger una gran variedad de organismos hematófagos contra los efectos tóxicos del hemo libre. Los mosquitos digieren la sangre extracelularmente y no producen hemozoína. El hemo se retiene en la matriz peritrófica , una capa de proteína y polisacáridos que cubre el intestino medio y separa las células intestinales del bolo sanguíneo.
Aunque la β-hematina se puede producir en ensayos de forma espontánea a pH bajo , el desarrollo de un método simple y confiable para medir la producción de hemozoína ha sido difícil. Esto se debe en parte a la continua incertidumbre sobre qué moléculas están involucradas en la producción de hemozoína, y en parte a la dificultad de medir la diferencia entre el hemo agregado o precipitado y la hemozoína genuina. Los ensayos actuales son sensibles y precisos, pero requieren varios pasos de lavado, por lo que son lentos y no son ideales para el cribado de alto rendimiento . Sin embargo, se han realizado algunos cribados con estos ensayos.
Estructura


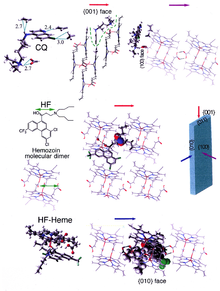
Los cristales de β- hematina están hechos de dímeros de moléculas de hematina que, a su vez, se unen mediante enlaces de hidrógeno para formar estructuras más grandes. En estos dímeros, un enlace coordinado hierro - oxígeno une el hierro central de una hematina con el oxígeno de la cadena lateral carboxilato de la hematina adyacente. Estos enlaces hierro-oxígeno recíprocos son muy inusuales y no se han observado en ningún otro dímero de porfirina. La β-hematina puede ser un dímero cíclico o un polímero lineal ; nunca se ha encontrado una forma polimérica en la hemozoína, lo que refuta la idea generalizada de que la hemozoína es producida por la enzima hemo-polimerasa.
Los cristales de hemozoína tienen una estructura triclínica distinta y son débilmente magnéticos . La diferencia entre la oxihemoglobina diamagnética de bajo espín y la hemozoína paramagnética se puede utilizar para el aislamiento. También exhiben dicroísmo óptico , lo que significa que absorben la luz con más fuerza a lo largo de su longitud que a lo ancho, lo que permite la detección automática de la malaria. La hemozoína se produce en una forma que, bajo la acción de un campo magnético aplicado , da lugar a un dicroísmo óptico inducido característico de la concentración de hemozoína; y se puede utilizar una medición precisa de este dicroísmo inducido ( dicroísmo circular magnético ) para determinar el nivel de infección por paludismo.
Inhibidores
La formación de hemozoína es un excelente objetivo farmacológico, ya que es esencial para la supervivencia del parásito de la malaria y está ausente del huésped humano. La hematina diana del fármaco se deriva del huésped y está en gran medida fuera del control genético del parásito, lo que dificulta el desarrollo de la resistencia al fármaco. Se cree que muchos fármacos de uso clínico actúan inhibiendo la formación de hemozoína en la vacuola de los alimentos. Esto evita la desintoxicación del hemo liberado en este compartimento y mata al parásito.
Los ejemplos mejor entendidos de tales inhibidores de la biocristalización de hematina son los fármacos quinolínicos como la cloroquina y la mefloquina . Estos fármacos se unen tanto a los cristales de hemo libre como a los de hemozoína y, por lo tanto, bloquean la adición de nuevas unidades de hemo a los cristales en crecimiento. La cara pequeña y de crecimiento más rápido es la cara a la que se cree que se unen los inhibidores.
Papel en la fisiopatología
La hemozoína se libera en la circulación durante la reinfección y los fagocitos del huésped la fagocitan in vivo e in vitro y altera funciones importantes en esas células. La mayoría de las alteraciones funcionales fueron efectos posfagocíticos a largo plazo, incluida la inhibición de la eritropoyesis mostrada in vitro. Por el contrario, también se demostró que durante la fagocitosis de nHZ se producía una potente estimulación a corto plazo del estallido oxidativo por parte de los monocitos humanos.