Luciferasa de luciérnaga - Firefly luciferase
| Luciferasa de luciérnaga | |||||||
|---|---|---|---|---|---|---|---|

| |||||||
| Identificadores | |||||||
| Organismo | |||||||
| Símbolo | N / A | ||||||
| PDB | 1LCI | ||||||
| UniProt | P08659 | ||||||
| |||||||
| Luciferasa de luciérnaga | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identificadores | |||||||||
| CE no. | 1.13.12.7 | ||||||||
| Bases de datos | |||||||||
| IntEnz | Vista IntEnz | ||||||||
| BRENDA | Entrada BRENDA | ||||||||
| FÁCIL | NiceZyme vista | ||||||||
| KEGG | Entrada KEGG | ||||||||
| MetaCyc | camino metabólico | ||||||||
| PRIAM | perfil | ||||||||
| Estructuras PDB | RCSB PDB PDBe PDBsum | ||||||||
| Ontología de genes | AmiGO / QuickGO | ||||||||
| |||||||||
La luciferasa de luciérnaga es la enzima emisora de luz responsable de la bioluminiscencia de las luciérnagas y los escarabajos clic . La enzima cataliza la oxidación de luciferina de luciérnaga , que requiere oxígeno y ATP . Debido al requerimiento de ATP, las luciferasas de luciérnaga se han utilizado ampliamente en biotecnología.
Mecanismo de reacción
La reacción química catalizada por la luciferasa de luciérnaga se lleva a cabo en dos pasos:
- luciferina + ATP → adenilato de luciferilo + PP i
- adenilato de luciferilo + O 2 → oxiluciferina + AMP + luz
La luz se produce porque la reacción forma oxiluciferina en un estado excitado electrónicamente . La reacción libera un fotón de luz cuando la oxiluciferina vuelve al estado fundamental .
El adenilato de luciferilo puede participar adicionalmente en una reacción secundaria con O 2 para formar peróxido de hidrógeno y deshidroluciferil-AMP. Aproximadamente el 20% del intermedio de adenilato de luciferilo se oxida en esta vía.
La luciferasa de luciérnaga genera luz a partir de la luciferina en un proceso de varios pasos. En primer lugar, D-luciferina se adenylated por MgATP para formar adenilato de luciferilo y pirofosfato. Después de la activación por ATP, el adenilato de luciferilo es oxidado por oxígeno molecular para formar un anillo de dioxetanona. Una reacción de descarboxilación forma un estado excitado de oxiluciferina, que se tautomeriza entre la forma ceto-enol. La reacción finalmente emite luz cuando la oxiluciferina regresa al estado fundamental.
Bifuncionalidad
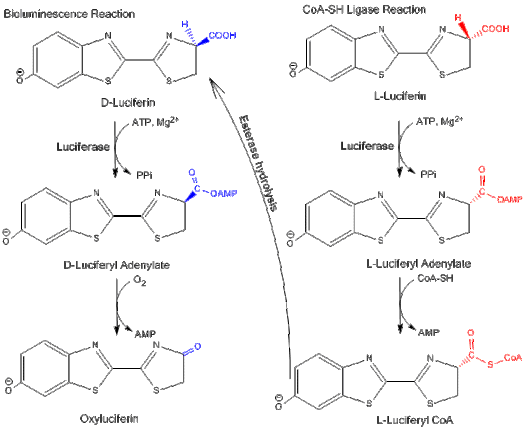
La luciferasa puede funcionar en dos vías diferentes: una vía de bioluminiscencia y una vía de ligasa CoA . En ambas vías, la luciferasa cataliza inicialmente una reacción de adenilación con MgATP. Sin embargo, en la vía de la CoA-ligasa, la CoA puede desplazar al AMP para formar luciferil CoA .
La acil-CoA sintetasa grasa activa de manera similar los ácidos grasos con ATP, seguido del desplazamiento de AMP con CoA. Debido a sus actividades similares, la luciferasa puede reemplazar la acil-CoA sintetasa grasa y convertir los ácidos grasos de cadena larga en acil-CoA graso para la oxidación beta .
Estructura
La estructura de la proteína de luciferasa de luciérnaga consta de dos dominios compactos : el dominio N-terminal y el dominio C-terminal . El dominio N-terminal está compuesto por dos láminas β en una estructura αβαβα y un barril β . Las dos hojas β se apilan una encima de la otra, con el barril β cubriendo el extremo de las hojas.
El dominio C-terminal está conectado al dominio N-terminal mediante una bisagra flexible, que puede separar los dos dominios. Las secuencias de aminoácidos en la superficie de los dos dominios enfrentados se conservan en luciferasa bacteriana y de luciérnaga, lo que sugiere fuertemente que el sitio activo está ubicado en la hendidura entre los dominios.
Durante una reacción, la luciferasa tiene un cambio conformacional y pasa a una forma "cerrada" con los dos dominios que se unen para encerrar el sustrato. Esto asegura que el agua se excluya de la reacción y no hidrolice el ATP o el producto excitado electrónicamente.
Diferencias espectrales en bioluminiscencia
El color de la bioluminiscencia de luciferasa de luciérnaga puede variar entre amarillo verdoso (λ max = 550 nm) y rojo (λ max = 620). Actualmente existen varios mecanismos diferentes que describen cómo la estructura de la luciferasa afecta el espectro de emisión del fotón y efectivamente el color de la luz emitida.
Un mecanismo propone que el color de la luz emitida depende de si el producto está en forma ceto o enol . El mecanismo sugiere que la luz roja se emite desde la forma ceto de oxiluciferina, mientras que la luz verde se emite desde la forma enólica de oxiluciferina. Sin embargo, la 5,5-dimetiloxiluciferina emite luz verde a pesar de que está restringida a la forma ceto porque no puede tautomerizar.
Otro mecanismo propone que la torsión del ángulo entre los anillos de benzotiazol y tiazol en oxilluciferina determina el color de la bioluminiscencia. Esta explicación propone que una forma plana con un ángulo de 0 ° entre los dos anillos corresponde a un estado de mayor energía y emite una luz verde de mayor energía, mientras que un ángulo de 90 ° pone la estructura en un estado de menor energía y emite un menor -luz roja de energía.
La explicación más reciente del color de bioluminiscencia examina el microambiente de la oxiluciferina excitada. Los estudios sugieren que las interacciones entre el producto del estado excitado y los residuos cercanos pueden forzar a la oxiluciferina a una forma de energía aún más alta, lo que resulta en la emisión de luz verde. Por ejemplo, Arg 218 tiene interacciones electrostáticas con otros residuos cercanos, lo que impide que la oxiluciferina se tautomerice a la forma enólica. De manera similar, otros resultados han indicado que el microambiente de la luciferasa puede forzar a la oxiluciferina a adoptar una estructura más rígida y de alta energía, lo que la obliga a emitir una luz verde de alta energía.
Regulación
La D-luciferina es el sustrato de la reacción de bioluminiscencia de la luciferasa de luciérnaga, mientras que la L-luciferina es el sustrato de la actividad de la luciferil-CoA sintetasa. Ambas reacciones son inhibidas por el enantiómero del sustrato: L-luciferina y D-luciferina inhiben la vía de bioluminiscencia y la vía de CoA-ligasa, respectivamente. Esto muestra que la luciferasa puede diferenciar entre los isómeros de la estructura de la luciferina.
La L-luciferina puede emitir una luz débil a pesar de que es un inhibidor competitivo de la D-luciferina y la vía de bioluminiscencia. Se emite luz porque la vía de síntesis de CoA se puede convertir en la reacción de bioluminiscencia hidrolizando el producto final a través de una esterasa de nuevo a D-luciferina.
La actividad de la luciferasa es inhibida adicionalmente por oxiluciferina y activada alostéricamente por ATP. Cuando el ATP se une a los dos sitios alostéricos de la enzima, aumenta la afinidad de la luciferasa para unirse al ATP en su sitio activo.