Carboxipeptidasa - Carboxypeptidase

Una carboxipeptidasa ( número CE 3.4.16 - 3.4.18) es una enzima proteasa que hidroliza (escinde) un enlace peptídico en el extremo carboxi-terminal (C-terminal) de una proteína o péptido . Esto contrasta con las aminopeptidasas , que escinden los enlaces peptídicos en el extremo N de las proteínas. Los seres humanos, los animales, las bacterias y las plantas contienen varios tipos de carboxipeptidasas que tienen diversas funciones que van desde el catabolismo hasta la maduración de proteínas.
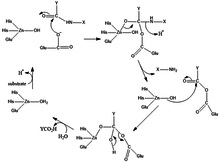
Mecanismo
El mecanismo para producir carboxipeptidasa implica que el sustrato coordinado del agua es reemplazado por sustrato de grupos carbonilo (C = O).
Funciones
Las primeras carboxipeptidasas estudiadas fueron las implicadas en la digestión de los alimentos (carboxipeptidasas pancreáticas A1, A2 y B). Sin embargo, la mayoría de las carboxipeptidasas conocidas no están implicadas en el catabolismo ; ayudan a madurar proteínas (p. ej., modificación postraduccional ) o regulan procesos biológicos. Por ejemplo, la biosíntesis de péptidos neuroendocrinos como la insulina requiere una carboxipeptidasa. Las carboxipeptidasas también funcionan en la coagulación de la sangre , la producción de factores de crecimiento , la cicatrización de heridas , la reproducción y muchos otros procesos.
Clasificaciones
Por mecanismo de sitio activo
Las carboxipeptidasas generalmente se clasifican en una de varias familias según su mecanismo de sitio activo.
- Las enzimas que utilizan un metal en el sitio activo se denominan "metalocarboxipeptidasas" (número CE 3.4.17).
- Otras carboxipeptidasas que usan residuos de serina del sitio activo se denominan "carboxipeptidasas de serina" (número CE 3.4.16).
- Aquellos que usan una cisteína de sitio activo se denominan "cisteína carboxipeptidasa" (o " tiol carboxipeptidasas") (número CE 3.4.18).
Estos nombres no se refieren a la selectividad del aminoácido que se escinde.
Por preferencia de sustrato
Otro sistema de clasificación para las carboxipeptidasas se refiere a su preferencia de sustrato.
- En este sistema de clasificación, las carboxipeptidasas que tienen una preferencia más fuerte por aquellos aminoácidos que contienen cadenas de hidrocarburos aromáticos o ramificados se denominan carboxipeptidasa A (A para aromático / alifático ).
- Las carboxipeptidasas que escinden los aminoácidos cargados positivamente ( arginina , lisina ) se denominan carboxipeptidasa B (B para básico ).
Una metalocarboxipeptidasa que escinde un glutamato C-terminal del péptido N-acetil-L-aspartil-L-glutamato se denomina " glutamato carboxipeptidasa ".
Una serina carboxipeptidasa que escinde el residuo C-terminal de los péptidos que contienen la secuencia -Pro-Xaa (Pro es prolina, Xaa es cualquier aminoácido en el extremo C-terminal de un péptido) se denomina " prolil carboxipeptidasa ".
Activación
Algunas carboxipeptidasas, pero no todas, se producen inicialmente en forma inactiva; esta forma precursora se denomina procarboxipeptidasa . En el caso de la carboxipeptidasa A pancreática, la forma de zimógeno inactivo , procarboxipeptidasa A, se convierte en su forma activa, carboxipeptidasa A, mediante la enzima tripsina . Este mecanismo asegura que las células en las que se produce la procarboxipeptidasa A no se digieran por sí mismas.
Ver también
- Carboxipeptidasa E
- Carboxipeptidasa A
- Categoría enzimática CE número 3.4
- Inhibidor de la fibrinólisis activable por trombina, también conocido como carboxipeptidasa B2 plasmática
- transpeptidasa bacteriana , una alanina carboxipeptidasa
- la bradicinina se descompone entre otras enzimas por la carboxipeptidasa N
- La carboxipeptidasa D-Ala es una proteína de unión a penicilina
- La fenilalanina podría inhibir la carboxipeptidasa A
- Martha L. Ludwig
Referencias
enlaces externos
- Carboxipeptidasas en los encabezados de temas médicos (MeSH) de la Biblioteca Nacional de Medicina de EE. UU .
- Sección de proteasa Stryer libro '02