Calnexina - Calnexin
La calnexina (CNX) es una proteína integral de 67 kDa (que aparece de forma diversa como una banda de 90 kDa, 80 kDa o 75 kDa en la transferencia Western según la fuente del anticuerpo) del retículo endoplásmico (ER). Se compone de una grande (50 kDa) N-terminal de calcio - unión lumenal dominio , una única hélice transmembrana y un corto (90 residuos ), ácido citoplásmica cola.
Función
Calnexin es un acompañante , que se caracteriza por ayudar al plegamiento de proteínas y al control de calidad, asegurando que solo las proteínas correctamente plegadas y ensambladas avancen más a lo largo de la vía secretora . Actúa específicamente para retener glicoproteínas N-ligadas desplegadas o sin ensamblar en el RE.
La calnexina se une solo a las N- glicoproteínas que tienen oligosacáridos GlcNAc2Man9Glc1 . Estos oligosacáridos monoglucosilados resultan del recorte de dos residuos de glucosa por la acción secuencial de dos glucosidasas , I y II. La glucosidasa II también puede eliminar el tercer y último residuo de glucosa. Si la glicoproteína no se pliega correctamente, una enzima llamada UGGT (para UDP-glucosa: glicoproteína glucosiltransferasa) agregará el residuo de glucosa nuevamente al oligosacárido, regenerando así la capacidad de la glicoproteína para unirse a la calnexina. Por tanto, la cadena de glicoproteína plegada incorrectamente merodea en el RE y la expresión de EDEM / Htm1p, lo que finalmente condena la glicoproteína de bajo rendimiento a la degradación mediante la eliminación de uno de los nueve residuos de manosa . La lectina manosa Yos-9 (OS-9 en humanos) marca y clasifica las glicoproteínas mal plegadas para su degradación. Yos-9 reconoce residuos de manosa expuestos después de la eliminación de α-manosidasa de una manosa externa de glicoproteínas mal plegadas.
La calnexina se asocia con la enzima de plegamiento de proteínas ERp57 para catalizar la formación de enlaces disulfuro específicos de glicoproteínas y también funciona como chaperona para el plegamiento de la cadena α del MHC de clase I en la membrana del RE. A medida que las cadenas α del MHC de clase I recién sintetizadas entran en el retículo endoplásmico, la calnexina se une a ellas y las retiene en un estado parcialmente plegado.
Después de que la β2-microglobulina se une al complejo de carga de péptidos (PLC) del MHC de clase I, la calreticulina y ERp57 se encargan de supervisar la proteína del MHC de clase I mientras que la tapasina une el complejo al transportador asociado con el complejo de procesamiento de antígenos (TAP). . Esta asociación prepara al MHC de clase I para unirse a un antígeno para su presentación en la superficie celular.
Una asociación prolongada de calnexina con PMP22 mutante mal plegado que se sabe que causa la enfermedad de Charcot-Marie-Tooth conduce al secuestro, degradación e incapacidad de PMP22 para transitar hacia la superficie de la célula de Schwann para mielinización . Después de rondas repetidas de unión de calnexina, la ubiquitina modifica la PMP22 mutante para su degradación por el proteasoma , así como una vía de recuperación de Golgi a ER para devolver cualquier PMP22 mal plegada que escapó del ER al aparato de Golgi.
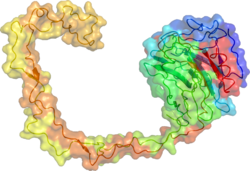
La estructura cristalina de rayos X de la calnexina reveló un dominio de lectina globular y un brazo hidrófobo largo que se extendía hacia afuera.
Cofactores
Los iones de ATP y calcio son cofactores implicados en la unión del sustrato para la calnexina.
Referencias
enlaces externos
- Calnexin en los encabezados de temas médicos (MeSH) de la Biblioteca Nacional de Medicina de EE. UU .
Otras lecturas
- Benyair R, Ron E, Lederkremer GZ (2011). Control de calidad, retención y degradación de proteínas en el retículo endoplásmico . Revista internacional de biología celular y molecular. 292 . págs. 197–280. doi : 10.1016 / B978-0-12-386033-0.00005-0 . ISBN 9780123860330. PMID 22078962 .
- Del Bem LE (febrero de 2011). "La historia evolutiva de los genes de calreticulina y calnexina en plantas verdes". Genetica . 139 (2): 225–9. doi : 10.1007 / s10709-010-9544-y . PMID 21222018 . S2CID 9228786 .
- Kleizen B, Braakman I (agosto de 2004). "Plegamiento de proteínas y control de calidad en el retículo endoplásmico". Opinión actual en biología celular . 16 (4): 343–9. doi : 10.1016 / j.ceb.2004.06.012 . hdl : 1874/5106 . PMID 15261665 .
- Rasmussen HH, van Damme J, Puype M, Gesser B, Celis JE, Vandekerckhove J (diciembre de 1992). "Microsecuencias de 145 proteínas registradas en la base de datos de proteínas de gel bidimensional de queratinocitos epidérmicos humanos normales". Electroforesis . 13 (12): 960–9. doi : 10.1002 / elps.11501301199 . PMID 1286667 . S2CID 41855774 .
- Galvin K, Krishna S, Ponchel F, Frohlich M, Cummings DE, Carlson R, Wands JR, Isselbacher KJ, Pillai S, Ozturk M (septiembre de 1992). "La proteína p88 de unión al antígeno de clase I del complejo principal de histocompatibilidad es el producto del gen de la calnexina" . Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 89 (18): 8452–6. Código Bibliográfico : 1992PNAS ... 89.8452G . doi : 10.1073 / pnas.89.18.8452 . PMC 49938 . PMID 1326756 .
- Pind S, Riordan JR, Williams DB (abril de 1994). "Participación de la calnexina chaperona del retículo endoplásmico (p88, IP90) en la biogénesis del regulador de conductancia transmembrana de fibrosis quística" . La revista de química biológica . 269 (17): 12784–8. doi : 10.1016 / S0021-9258 (18) 99944-8 . PMID 7513695 .
- Honoré B, Rasmussen HH, Celis A, Leffers H, Madsen P, Celis JE (1992). "Las chaperonas moleculares HSP28, GRP78, endoplasmina y calnexina exhiben niveles sorprendentemente diferentes en queratinocitos inactivos en comparación con sus contrapartes normales y transformadas en proliferación: clonación de ADNc y expresión de calnexina". Electroforesis . 15 (3–4): 482–90. doi : 10.1002 / elps.1150150166 . PMID 8055875 . S2CID 22393279 .
- Tjoelker LW, Seyfried CE, Eddy RL, Byers MG, Shows TB, Calderon J, Schreiber RB, Gray PW (marzo de 1994). "Clonación de cDNA de calnexina humana, de ratón y de rata: identificación de posibles motivos de unión al calcio y localización de genes en el cromosoma humano 5". Bioquímica . 33 (11): 3229–36. doi : 10.1021 / bi00177a013 . PMID 8136357 .
- Lenter M, Vestweber D (abril de 1994). "Las cadenas de integrina beta 1 y alfa 6 se asocian con la chaperona calnexina antes del ensamblaje de la integrina" . La revista de química biológica . 269 (16): 12263–8. doi : 10.1016 / S0021-9258 (17) 32710-2 . PMID 8163531 .
- Rajagopalan S, Xu Y, Brenner MB (enero de 1994). "Retención de componentes no ensamblados de proteínas integrales de membrana por calnexina". Ciencia . 263 (5145): 387–90. Bibcode : 1994Sci ... 263..387R . doi : 10.1126 / science.8278814 . PMID 8278814 .
- David V, Hochstenbach F, Rajagopalan S, Brenner MB (mayo de 1993). "La interacción con proteínas recién sintetizadas y retenidas en el retículo endoplásmico sugiere una función de chaperona para la proteína de membrana integral humana IP90 (calnexina)" . La revista de química biológica . 268 (13): 9585–92. doi : 10.1016 / S0021-9258 (18) 98391-2 . PMID 8486646 .
- Bellovino D, Morimoto T, Tosetti F, Gaetani S (enero de 1996). "La proteína de unión al retinol y la transtiretina se secretan como un complejo formado en el retículo endoplásmico de las células del hepatocarcinoma humano HepG2". Investigación celular experimental . 222 (1): 77–83. doi : 10.1006 / excr.1996.0010 . PMID 8549676 .
- Otteken A, Moss B (enero de 1996). "La calreticulina interactúa con la glicoproteína de la envoltura del virus de inmunodeficiencia humana tipo 1 recién sintetizada, lo que sugiere una función de chaperona similar a la de la calnexina" . La revista de química biológica . 271 (1): 97–103. doi : 10.1074 / jbc.271.1.97 . PMID 8550632 .
- Devergne O, Hummel M, Koeppen H, Le Beau MM, Nathanson EC, Kieff E, Birkenbach M (febrero de 1996). "Una nueva proteína relacionada con la interleucina-12 p40 inducida por la infección latente del virus de Epstein-Barr en los linfocitos B" . Revista de Virología . 70 (2): 1143–53. doi : 10.1128 / JVI.70.2.1143-1153.1996 . PMC 189923 . PMID 8551575 .
- Andersson B, Wentland MA, Ricafrente JY, Liu W, Gibbs RA (abril de 1996). "Un método de" doble adaptador "para mejorar la construcción de bibliotecas de escopetas". Bioquímica analítica . 236 (1): 107-13. doi : 10.1006 / abio.1996.0138 . PMID 8619474 .
- van Leeuwen JE, Kearse KP (abril de 1996). "La calnexina se asocia exclusivamente con proteínas alfa del receptor de antígeno de células T (TCR) y CD3 delta individuales que contienen glucanos recortados de forma incompleta que no se ensamblan en complejos TCR de múltiples subunidades" . La revista de química biológica . 271 (16): 9660–5. doi : 10.1074 / jbc.271.16.9660 . PMID 8621641 .
- Oliver JD, Hresko RC, Mueckler M, High S (junio de 1996). "El transportador de glucosa glut 1 interactúa con calnexina y calreticulina" . La revista de química biológica . 271 (23): 13691–6. doi : 10.1074 / jbc.271.23.13691 . PMID 8662691 .
- Li Y, Bergeron JJ, Luo L, Ou WJ, Thomas DY, Kang CY (septiembre de 1996). "Efectos de la escisión ineficaz de la secuencia señal de gp 120 del VIH-1 sobre su asociación con calnexina, plegamiento y transporte intracelular" . Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 93 (18): 9606-11. Código Bibliográfico : 1996PNAS ... 93.9606L . doi : 10.1073 / pnas.93.18.9606 . PMC 38475 . PMID 8790377 .
- Trombetta ES, Simons JF, Helenius A (noviembre de 1996). "La glucosidasa II del retículo endoplásmico se compone de una subunidad catalítica, conservada desde la levadura hasta los mamíferos, y una subunidad no catalítica que contiene HDEL fuertemente unida" . La revista de química biológica . 271 (44): 27509–16. doi : 10.1074 / jbc.271.44.27509 . PMID 8910335 .
- Tatu U, Helenius A (febrero de 1997). "Interacciones entre glicoproteínas recién sintetizadas, calnexina y una red de chaperonas residentes en el retículo endoplásmico" . The Journal of Cell Biology . 136 (3): 555–65. doi : 10.1083 / jcb.136.3.555 . PMC 2134297 . PMID 9024687 .
- Wiest DL, Bhandoola A, Punt J, Kreibich G, McKean D, Singer A (marzo de 1997). "Retención incompleta del retículo endoplásmico (ER) en timocitos inmaduros, como lo revela la expresión superficial de chaperonas moleculares" residentes en ER "" . Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 94 (5): 1884–9. Código bibliográfico : 1997PNAS ... 94.1884W . doi : 10.1073 / pnas.94.5.1884 . PMC 20012 . PMID 9050874 .
- Yu W, Andersson B, Worley KC, Muzny DM, Ding Y, Liu W, Ricafrente JY, Wentland MA, Lennon G, Gibbs RA (abril de 1997). "Secuenciación de cDNA de concatenación a gran escala" . Investigación del genoma . 7 (4): 353–8. doi : 10.1101 / gr.7.4.353 . PMC 139146 . PMID 9110174 .