Dedo de zinc - Zinc finger

Un dedo de zinc es un pequeño motivo estructural de proteína que se caracteriza por la coordinación de uno o más iones de zinc (Zn 2+ ) para estabilizar el pliegue. Originalmente se acuñó para describir la apariencia similar a un dedo de una estructura hipotética del factor de transcripción IIIA de la rana africana con garras ( Xenopus laevis ) . Sin embargo, se ha encontrado que abarca una amplia variedad de estructuras proteicas diferentes en células eucariotas . Se demostró originalmente que Xenopus laevis TFIIIA contenía zinc y requería el metal para funcionar en 1983, el primer requerimiento de zinc reportado para una proteína reguladora de genes seguido poco después por el factor Krüppel en Drosophila . A menudo aparece como un dominio de unión a metales en proteínas de múltiples dominios.
Las proteínas que contienen dedos de zinc ( proteínas de dedos de zinc ) se clasifican en varias familias estructurales diferentes. A diferencia de muchas otras estructuras supersecundarias claramente definidas , como las llaves griegas o las horquillas β , existen varios tipos de dedos de zinc, cada uno con una arquitectura tridimensional única. La clase de proteína de dedo de zinc en particular está determinada por esta estructura tridimensional, pero también se puede reconocer en función de la estructura primaria de la proteína o la identidad de los ligandos que coordinan el ión de zinc. Sin embargo, a pesar de la gran variedad de estas proteínas, la gran mayoría funciona típicamente como módulos de interacción que se unen al ADN , ARN , proteínas u otras moléculas pequeñas y útiles, y las variaciones en la estructura sirven principalmente para alterar la especificidad de unión de una proteína en particular. .
Desde su descubrimiento original y la elucidación de su estructura, estos módulos de interacción han demostrado ser ubicuos en el mundo biológico y pueden encontrarse en el 3% de los genes del genoma humano. Además, los dedos de zinc se han vuelto extremadamente útiles en diversas capacidades terapéuticas y de investigación. Diseñar dedos de zinc para que tengan afinidad por una secuencia específica es un área de investigación activa, y las nucleasas de dedos de zinc y los factores de transcripción de dedos de zinc son dos de las aplicaciones más importantes de esto que se han realizado hasta la fecha.
Historia
Los dedos de zinc se identificaron por primera vez en un estudio de transcripción en la rana de garras africana , Xenopus laevis, en el laboratorio de Aaron Klug . Un estudio de la transcripción de una secuencia de ARN particular reveló que la fuerza de unión de un factor de transcripción pequeño (factor de transcripción IIIA; TFIIIA) se debía a la presencia de estructuras similares a dedos que coordinaban el zinc. La secuenciación de aminoácidos de TFIIIA reveló nueve secuencias en tándem de 30 aminoácidos, incluidos dos pares invariantes de residuos de cisteína e histidina. La estructura fina de absorción de rayos X extendida confirmó la identidad de los ligandos de zinc: dos cisteínas y dos histidinas. Se pensaba que el bucle de unión al ADN formado por la coordinación de estos ligandos por el zinc se parecía a los dedos, de ahí el nombre. Esto fue seguido poco después por el descubrimiento del factor Krüppel en Drosophila por el equipo de Schuh en 1986. Un trabajo más reciente en la caracterización de proteínas en varios organismos ha revelado la importancia de los iones zinc en la estabilización de polipéptidos.
Las estructuras cristalinas de los complejos de ADN de dedos de zinc resueltos en 1991 y 1993 revelaron el patrón canónico de interacciones de los dedos de zinc con el ADN. Se encuentra que la unión del dedo de zinc es distinta de muchas otras proteínas de unión al ADN que se unen al ADN a través de la simetría doble de la doble hélice, en cambio, los dedos de zinc se unen linealmente en tándem para unir secuencias de ácido nucleico de diferentes longitudes. Los dedos de zinc a menudo se unen a una secuencia de ADN conocida como caja GC . La naturaleza modular del motivo del dedo de zinc permite que un gran número de combinaciones de secuencias de ADN y ARN se unan con un alto grado de afinidad y especificidad y, por lo tanto, es ideal para la ingeniería de proteínas que pueden dirigirse y unirse a secuencias de ADN específicas. En 1994, se demostró que una proteína de tres dedos construida artificialmente puede bloquear la expresión de un oncogén en una línea celular de ratón. Desde entonces, se han construido dedos de zinc fusionados con varios otros dominios efectores, algunos con importancia terapéutica.
Dominio
Los dominios de dedos de zinc (Znf) son motivos proteicos relativamente pequeños que contienen múltiples protuberancias en forma de dedos que hacen contactos en tándem con su molécula objetivo. Algunos de estos dominios se unen al zinc, pero muchos no lo hacen, sino que se unen a otros metales como el hierro, o no unen ningún metal. Por ejemplo, algunos miembros de la familia forman puentes de sal para estabilizar los pliegues en forma de dedos . Se identificaron por primera vez como un motivo de unión al ADN en el factor de transcripción TFIIIA de Xenopus laevis (rana de garras africanas), sin embargo, ahora se reconoce que se unen a sustratos de ADN, ARN, proteínas y / o lípidos . Sus propiedades de unión dependen de la secuencia de aminoácidos de los dominios de los dedos y del conector entre los dedos, así como de las estructuras de orden superior y el número de dedos. Los dominios Znf se encuentran a menudo en grupos, donde los dedos pueden tener diferentes especificidades de unión. Los motivos Znf se encuentran en varias superfamilias de proteínas no relacionadas , que varían tanto en secuencia como en estructura. Muestran una considerable versatilidad en los modos de unión, incluso entre miembros de la misma clase (por ejemplo, algunos se unen al ADN, otros a la proteína), lo que sugiere que los motivos Znf son andamios estables que han desarrollado funciones especializadas. Por ejemplo, las proteínas que contienen Znf funcionan en la transcripción de genes , traducción, tráfico de ARNm, organización del citoesqueleto , desarrollo epitelial , adhesión celular , plegamiento de proteínas, remodelación de cromatina y detección de zinc, por nombrar solo algunos. Los motivos que se unen al zinc son estructuras estables y rara vez experimentan cambios conformacionales al unirse a su objetivo.
Clases
Inicialmente, el término dedo de zinc se utilizó únicamente para describir el motivo de unión al ADN que se encuentra en Xenopus laevis ; sin embargo, ahora se usa para referirse a cualquier número de estructuras relacionadas por su coordinación de un ion zinc. En general, los dedos de zinc coordinan los iones de zinc con una combinación de residuos de cisteína e histidina . Originalmente, el número y orden de estos residuos se utilizó para clasificar diferentes tipos de dedos de zinc (por ejemplo, Cys 2 His 2 , Cys 4 y Cys 6 ). Más recientemente, se ha utilizado un método más sistemático para clasificar las proteínas con dedos de zinc. Este método clasifica las proteínas con dedos de zinc en "grupos de pliegues" basándose en la forma general de la estructura de la proteína en el dominio plegado. Los "grupos de pliegues" más comunes de dedos de zinc son los de tipo Cys 2 His 2 (el "dedo de zinc clásico"), la clave de sol y la cinta de zinc.
La siguiente tabla muestra las diferentes estructuras y sus características clave:
Cys 2 Su 2
| Dedo de zinc, tipo C2H2 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identificadores | |||||||||
| Símbolo | zf-C2H2 | ||||||||
| Pfam | PF00096 | ||||||||
| Clan pfam | CL0361 | ||||||||
| InterPro | IPR007087 | ||||||||
| PROSITE | PS00028 | ||||||||
| |||||||||
El grupo Cys 2 His 2 pliegues (C2H2) es, con mucho, la clase mejor caracterizada de dedos de zinc, y es común en factores de transcripción de mamíferos. Dichos dominios adoptan un pliegue ββα simple y tienen el motivo de secuencia de aminoácidos :
- X 2 -Cys-X 2,4 -Cys-X 12 -His-X 3,4,5 -His
Esta clase de dedos de zinc puede tener una variedad de funciones, como la unión de ARN y la mediación de interacciones proteína-proteína, pero es mejor conocida por su papel en proteínas de unión a ADN específicas de secuencia como Zif268 (Egr1). En tales proteínas, los dominios de dedos de zinc individuales ocurren típicamente como repeticiones en tándem con dos, tres o más dedos que comprenden el dominio de unión al ADN de la proteína. Estas matrices en tándem pueden unirse en el surco principal del ADN y normalmente están espaciadas a intervalos de 3 pb. La α-hélice de cada dominio (a menudo llamada "hélice de reconocimiento") puede hacer contactos específicos de secuencia con bases de ADN; los residuos de una única hélice de reconocimiento pueden entrar en contacto con cuatro o más bases para producir un patrón superpuesto de contactos con los dedos de zinc adyacentes.
Nudillo de mordaza
| Nudillo de zinc | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identificadores | |||||||||
| Símbolo | zf-CCHC | ||||||||
| Pfam | PF00098 | ||||||||
| InterPro | IPR001878 | ||||||||
| INTELIGENTE | SM00343 | ||||||||
| PROSITE | PS50158 | ||||||||
| |||||||||
Este grupo de pliegues está definido por dos hebras β cortas conectadas por un giro (nudillo de zinc) seguido de una hélice o bucle corto y se asemeja al motivo clásico Cys 2 His 2 con una gran parte de la hélice y horquilla β truncada.
La proteína de la nucleocápside retroviral (NC) del VIH y otros retrovirus relacionados son ejemplos de proteínas que poseen estos motivos. El dedo de zinc en forma de mordaza en la proteína NC del VIH es el objetivo de una clase de medicamentos conocidos como inhibidores del dedo de zinc .
Clave de sol
El motivo de clave de sol consiste en una horquilla β en el extremo N-terminal y una hélice α en el terminal C, cada una de las cuales contribuye con dos ligandos para la unión de zinc, aunque un bucle y una segunda horquilla β de diferente longitud y conformación pueden estar presente entre la horquilla β N-terminal y la hélice α C-terminal. Estos dedos están presentes en un grupo diverso de proteínas que con frecuencia no comparten una secuencia o similitud funcional entre sí. Las proteínas mejor caracterizadas que contienen dedos de zinc en clave de sol son los receptores de hormonas nucleares .
Cinta de zinc
| Unión de zinc TFIIB | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identificadores | |||||||||
| Símbolo | TF_Zn_Ribbon | ||||||||
| Pfam | PF08271 | ||||||||
| Clan pfam | Zn_Beta_Ribbon | ||||||||
| InterPro | IPR013137 | ||||||||
| PROSITE | PS51134 | ||||||||
| |||||||||
El pliegue de la cinta de zinc se caracteriza por dos horquillas beta que forman dos subsitios de unión de zinc estructuralmente similares.
Zn 2 / Cys 6
| Fúngico Zn (2) -Cys (6) dominio de racimo binuclear | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identificadores | |||||||||
| Símbolo | Zn_clus | ||||||||
| Pfam | PF00172 | ||||||||
| InterPro | IPR001138 | ||||||||
| INTELIGENTE | GAL4 | ||||||||
| PROSITE | PS00463 | ||||||||
| CDD | cd00067 | ||||||||
| |||||||||
Los miembros canónicos de esta clase contienen un grupo de zinc binuclear en el que dos iones de zinc están unidos por seis residuos de cisteína . Estos dedos de zinc se pueden encontrar en varios factores de transcripción, incluida la proteína de levadura Gal4 .
| zf-C2HC | |||||||||
|---|---|---|---|---|---|---|---|---|---|
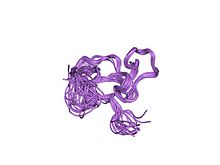 estructura de la solución de un dominio cchhc del factor 1 del dedo de zinc neuronal
| |||||||||
| Identificadores | |||||||||
| Símbolo | zf-C2HC | ||||||||
| Pfam | PF01530 | ||||||||
| InterPro | IPR002515 | ||||||||
| |||||||||
| zf-C2HC5 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identificadores | |||||||||
| Símbolo | zf-C2HC5 | ||||||||
| Pfam | PF06221 | ||||||||
| InterPro | IPR009349 | ||||||||
| |||||||||
Diverso
La proteína antiviral de dedos de zinc (ZAP) se une al sitio CpG. Se utiliza en mamíferos como defensa antiviral.
Aplicaciones
Pueden usarse diversas técnicas de ingeniería de proteínas para alterar la especificidad de unión al ADN de los dedos de zinc y pueden usarse repeticiones en tándem de dichos dedos de zinc diseñados para seleccionar como diana secuencias de ADN genómico deseadas. La fusión de un segundo dominio de proteína, como un activador o represor transcripcional, a una serie de dedos de zinc diseñados que se unen cerca del promotor de un gen dado, puede usarse para alterar la transcripción de ese gen. Las fusiones entre matrices de dedos de zinc modificadas genéticamente y dominios de proteínas que escinden o modifican el ADN también pueden usarse para dirigir esas actividades a los loci genómicos deseados. Las aplicaciones más comunes para las matrices de dedos de zinc diseñadas incluyen factores de transcripción de dedos de zinc y nucleasas de dedos de zinc , pero también se han descrito otras aplicaciones. Los arreglos típicos de dedos de zinc diseñados tienen entre 3 y 6 motivos de dedos de zinc individuales y unen sitios de destino que van desde 9 pares de bases hasta 18 pares de bases de longitud. Las matrices con 6 motivos de dedos de zinc son particularmente atractivas porque se unen a un sitio objetivo que es lo suficientemente largo como para tener una buena posibilidad de ser único en el genoma de un mamífero.
Nucleasas de dedos de zinc
Las matrices de dedos de zinc diseñadas a menudo se fusionan con un dominio de escisión de ADN (generalmente el dominio de escisión de FokI ) para generar nucleasas de dedos de zinc . Tales fusiones de dedos de zinc-FokI se han convertido en reactivos útiles para manipular genomas de muchos organismos superiores, incluidos Drosophila melanogaster , Caenorhabditis elegans , tabaco , maíz , pez cebra , varios tipos de células de mamíferos y ratas . El direccionamiento de una ruptura de doble hebra a un locus genómico deseado puede usarse para introducir mutaciones de cambio de marco en la secuencia codificante de un gen debido a la naturaleza propensa a errores de la ruta de reparación del ADN no homóloga. Si también se usa una "secuencia donante" de ADN homólogo, entonces el locus genómico se puede convertir en una secuencia definida a través de la ruta de reparación dirigida por homología. Un ensayo clínico en curso está evaluando las nucleasas de dedos de zinc que alteran el gen CCR5 en las células T humanas CD4 + como un tratamiento potencial para el VIH / SIDA .
Métodos de ingeniería de matrices de dedos de zinc
La mayoría de las matrices de dedos de zinc diseñadas se basan en el dominio de dedos de zinc del factor de transcripción murino Zif268, aunque algunos grupos han utilizado matrices de dedos de zinc basadas en el factor de transcripción humano SP1. Zif268 tiene tres motivos de dedos de zinc individuales que se unen colectivamente a una secuencia de 9 pb con alta afinidad. La estructura de esta proteína unida al ADN se resolvió en 1991 y estimuló una gran cantidad de investigación sobre arreglos de dedos de zinc diseñados. En 1994 y 1995, varios grupos utilizaron la presentación de fagos para alterar la especificidad de un solo dedo de zinc de Zif268. Hay dos métodos principales que se utilizan actualmente para generar matrices de dedos de zinc de ingeniería, ensamblaje modular y un sistema de selección de bacterias, y existe cierto debate sobre qué método es el más adecuado para la mayoría de las aplicaciones.
El método más sencillo para generar nuevas matrices de dedos de zinc es combinar "módulos" de dedos de zinc más pequeños de especificidad conocida. La estructura de la proteína Zif268 con dedos de zinc unida al ADN descrita por Pavletich y Pabo en su publicación de 1991 ha sido clave para gran parte de este trabajo y describe el concepto de obtener dedos para cada uno de los 64 posibles tripletes de pares de bases y luego mezclarlos y emparejarlos. dedos para diseñar proteínas con cualquier especificidad de secuencia deseada. El proceso de ensamblaje modular más común implica la combinación de dedos de zinc separados que pueden reconocer cada uno una secuencia de ADN de 3 pares de bases para generar matrices de 3, 4, 5 o 6 dedos que reconocen los sitios objetivo que van desde 9 pares de bases hasta 18 pares de bases en largo. Otro método utiliza módulos de 2 dedos para generar matrices de dedos de zinc con hasta seis dedos de zinc individuales. El Laboratorio Barbas del Instituto de Investigación Scripps utilizó la presentación de fagos para desarrollar y caracterizar dominios de dedos de zinc que reconocen la mayoría de las secuencias de tripletes de ADN, mientras que otro grupo aisló y caracterizó dedos individuales del genoma humano. Un posible inconveniente del ensamblaje modular en general es que las especificidades de los dedos de zinc individuales pueden superponerse y pueden depender del contexto de los dedos de zinc circundantes y del ADN. Un estudio reciente demostró que una alta proporción de matrices de dedos de zinc de 3 dedos generadas por ensamblaje modular no logran unir su objetivo previsto con suficiente afinidad en un ensayo bacteriano de dos híbridos y no funcionan como nucleasas de dedos de zinc , pero la tasa de éxito fue algo más alto cuando se apuntaron a sitios de la forma GNNGNNGNN.
Un estudio posterior utilizó ensamblaje modular para generar nucleasas de dedos de zinc con matrices de 3 dedos y matrices de 4 dedos y observó una tasa de éxito mucho mayor con las matrices de 4 dedos. También se ha informado de una variante de ensamblaje modular que tiene en cuenta el contexto de los dedos vecinos y este método tiende a producir proteínas con un rendimiento mejorado en relación con el ensamblaje modular estándar.
Se han utilizado numerosos métodos de selección para generar matrices de dedos de zinc capaces de dirigirse a las secuencias deseadas. Los esfuerzos de selección iniciales utilizaron la presentación de fagos para seleccionar proteínas que se unían a una diana de ADN determinada de un gran grupo de matrices de dedos de zinc parcialmente aleatorizadas. Esta técnica es difícil de usar en más de un dedo de zinc a la vez, por lo que se desarrolló un proceso de varios pasos que generó una matriz de 3 dedos completamente optimizada al agregar y optimizar un solo dedo de zinc a la vez. Los esfuerzos más recientes han utilizado sistemas de un híbrido de levadura, sistemas bacterianos de un híbrido y dos híbridos y células de mamíferos. Un nuevo método prometedor para seleccionar nuevas matrices de dedos de zinc de 3 dedos utiliza un sistema bacteriano de dos híbridos y sus creadores lo han denominado "ABIERTO". Este sistema combina conjuntos preseleccionados de dedos de zinc individuales que se seleccionaron cada uno para unir un triplete dado y luego utiliza una segunda ronda de selección para obtener matrices de 3 dedos capaces de unir una secuencia deseada de 9 pb. Este sistema fue desarrollado por el Zinc Finger Consortium como una alternativa a las fuentes comerciales de arreglos de dedos de zinc diseñados. Es algo difícil comparar directamente las propiedades de unión de las proteínas generadas con este método con las proteínas generadas por ensamblaje modular, ya que nunca se han informado los perfiles de especificidad de las proteínas generadas por el método OPEN.
Ejemplos de
Esta entrada representa el dominio de dedo de zinc tipo CysCysHisCys (C2HC) que se encuentra en eucariotas . Las proteínas que contienen estos dominios incluyen:
- Acetiltransferasas de histonas de la familia MYST
- Factor de transcripción de mielina Myt1
- Supresor de la proteína 18 de tumorigenicidad (ST18)
Ver también
- Dedo de zinc B-box
- Proteína de unión al ADN
- Caja asociada Krüppel
- Dominio de dedo RING
- Motivo de secuencia
- Receptor de hormonas esteroides
- Motivo estructural
- Efector TAL
- Nucleasa efectora de tipo activador de la transcripción
- Inhibidor de dedos de zinc
- Nucleasa de dedos de zinc
- Factor de transcripción de dedos de zinc
Referencias
enlaces externos
- Familia C2H2 Archivado el 15 de febrero de 2016 en Wayback Machine en PlantTFDB: Base de datos de factores de transcripción de plantas
- McDowall J. "Proteína del mes: dedos de zinc" . Laboratorio Europeo de Biología Molecular - Instituto Europeo de Bioinformática (EMBL-EBI) . Consultado el 13 de enero de 2008 .
- Goodsell DS. "Molécula del mes: dedos de zinc" . Research Collaboratory for Structural Bioinformática (RCSB) Protein Data Bank (PDB). Archivado desde el original el 31 de mayo de 2008 . Consultado el 13 de enero de 2008 .
- La doble hélice entre el dedo de zinc.
- Sitio de diseño e información de Zinc Finger Tools
- Catálogo de genes humanos KZNF Archivado el 16 de marzo de 2012 en la Wayback Machine.
- Dominio tipo C2H2 de dedo de zinc en PROSITE
- Entrada para dedos de zinc clase C2H2 en la base de datos SMART
- El Consorcio Zinc Finger
- ZiFiT- Herramienta de diseño de dedos de zinc
- Materiales del consorcio Zinc Finger de Addgene
- Predecir las especificidades de unión al ADN para las proteínas de dedo de zinc C2H2