Nitrato de vanadilo - Vanadyl nitrate
|
|
| Nombres | |
|---|---|
| Otros nombres
trinitratooxovanadio
|
|
| Identificadores | |
|
Modelo 3D ( JSmol )
|
|
| ChemSpider | |
|
PubChem CID
|
|
|
|
|
|
| Propiedades | |
| VO (NO 3 ) 3 | |
| Masa molar | 252,953 g / mol |
| Apariencia | líquido amarillo. |
| Punto de fusion | 2 ° C (36 ° F; 275 K) |
| Punto de ebullición | 86 a 91 ° C (187 a 196 ° F; 359 a 364 K) a 0,7 mm Hg |
| agua | |
| Riesgos | |
| Principales peligros | oxidante |
| Compuestos relacionados | |
|
Compuestos relacionados
|
nitrato de titanio , perclorato de vanadilo |
|
Salvo que se indique lo contrario, los datos se proporcionan para materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa). |
|
| Referencias de Infobox | |
El nitrato de vanadio , también llamado oxitrinitrato de vanadio u oxinitrato de vanadio, es un compuesto inorgánico de vanadio en el estado de oxidación +5 con ligandos de nitrato y oxígeno. La fórmula es VO (NO 3 ) 3 . Es un líquido viscoso de color amarillo pálido.
Producción
Se elabora sumergiendo pentóxido de vanadio en pentóxido de dinitrógeno líquido durante aproximadamente dos días a temperatura ambiente. El rendimiento de este método es de aproximadamente el 85%.
- V 2 O 5 + 3 N 2 O 5 → 2 VO (NO 3 ) 3 .
La purificación se puede lograr mediante destilación al vacío.
El mononitratodioxovanadio (VO 2 NO 3 ) es un intermedio en esta síntesis. Es un sólido rojo ladrillo.
El nitrato de vanadilo también se puede preparar a partir de tricloruro de vanadilo VOCl 3 y pentóxido de dinitrógeno.
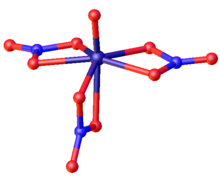
Estructura
VO (NO 3 ) 3 tiene una forma bipirámide pentagonal distorsionada con simetría C s (espejo) idealizada . El enlace de oxígeno de vanadio (157,2 pm) es típico del vanadilo (V). Dos grupos de nitratos en el plano pentagonal son bidentados (las distancias VO varían de 199 a 206 pm). El tercer nitrato se extiende por el plano pentagonal (197 pm) hasta la posición trans a oxo (223 pm).
Propiedades
El nitrato de vanadilo se disuelve en diclorometano, nitrometano, tetracloruro de carbono e hidrocarburos saturados. El 1-hexeno u otros hidrocarburos insaturados se encienden al entrar en contacto con el nitrato de vanadilo. Al contacto con el agua, se hidroliza irreversiblemente liberando ácido nítrico . El ácido nítrico se forma como resultado de la reacción con el agua.
El espectro ultravioleta del líquido muestra una banda de absorción con un pico a 208 nm con un hombro a 242 nm. A 55 ° C, el nitrato de vanadilo gaseoso tiene bandas de absorción también a 486, 582 y 658 nm en el espectro de luz visual. En la región infrarroja, el nitrato de vanadilo líquido absorbe en 1880, 1633, 1612, 1560, 1306, 1205, 1016, 996, 965, 895, 783, 632, 457, 357, 301, 283, 234, 193, 133, 93 y 59 cm −1 . El nitrato de vanadilo gaseoso tiene bandas de absorción a 775, 783, 786, 962.5, 994.4, 997.5, 1000.5, 1006.2, 1012, 1016.3, 1020, 1198, 1211, 1216.3, 1564, 1612, 1629, 1632, 1635, 1648 y 1888 cm - 1 . Muchas de estas bandas se deben al estiramiento de los enlaces nitrógeno-oxígeno, pero 1016,3 cm -1 se debe al doble enlace vanadio-oxígeno. 786 se debe a un movimiento fuera de fase en NO, y 775 se debe a una deformación en ON = O en el plano del espejo.
Reacciones
Es un agente nitrante para compuestos aromáticos. Las reacciones proceden a temperatura ambiente. A menudo, se utiliza diclorometano como disolvente inerte. El nitrotolueno, el benzoato de metilo y el ácido benzoico son nitrados por exposición prolongada durante unos pocos días. El benzonitrilo no reacciona.
El nitrato de vanadilo forma un aducto sólido de color amarillo pálido con trifluoruro de boro . También se forma un aducto con acetonitrilo .
Referencias
- ^ a b c d e f Paloma, Michael FA; Berthold Manz; John Montgomery; Gerald Pattenden; Simon A. Wood (1998). "Oxitrinitrato de vanadio (V), VO (NO3) 3. Potente reactivo para la nitración de compuestos aromáticos a temperatura ambiente en condiciones no ácidas". Revista de la Sociedad Química, Transacciones de Perkin 1 (10): 1589-1590. doi : 10.1039 / A801771I . ISSN 0300-922X .
- ↑ a b c Brandán, Silvia A .; C. Socolsky; Aida Ben Altabef (2009). "Cálculos DFT del campo de fuerza molecular del nitrato de vanadilo, VO (NO3) 3". Zeitschrift für anorganische und allgemeine Chemie . 635 (3): 582–592. doi : 10.1002 / zaac.200801244 . ISSN 0044-2313 .
- ^ a b c d e Harris, Arlo D .; John C. Trebellas (26 de abril de 1962). "AD296097 Estudios experimentales de las reacciones de N2O5 con anhídridos de ácido metálico y BF3" . Estación Arlington Hall: Agencia de Información Técnica de Servicios Armados . Consultado el 30 de septiembre de 2014 .
- ^ Algodón, F. Albert; Wilkinson, Geoffrey (1966). Química inorgánica avanzada Un texto completo (5 ed.). John Wiley. pag. 814.
- ^ Pantonin, John A .; Albert K. Fischer; Edward A. Heintz (1960). "La preparación de mononitratodioxovanadio (V), VO2NO3". Revista de Química Inorgánica y Nuclear . 14 (1-2): 145-147. doi : 10.1016 / 0022-1902 (60) 80220-5 . ISSN 0022-1902 .
- ^ Schmeisser, Martin (1955). "Die Chemie der anorganischen Acylnitrate (ein Problem des Nitrylchlorids) und Acylperchlorate (ein Problem des Dichlorhexoxyds)". Angewandte Chemie (en alemán). 67 (17–18): 493–501. doi : 10.1002 / ange.19550671708 . ISSN 0044-8249 .
- ^ Inteligente, Bruce A .; Heather E. Robertson; David WH Rankin; Eric G. Hope; Colin J. Marsden (1999). "¿Cuál es el número de coordinación de vanadio en nitrato de vanadilo, VO (NO3) 3? Un estudio de su estructura molecular en la fase gaseosa por difracción de electrones y cálculos ab initio". Revista de la Sociedad Química, Transacciones de Dalton (3): 473–478. doi : 10.1039 / A806710D . ISSN 0300-9246 . (Descarga gratis)
- ↑ Davidson, G. (1 de enero de 2000). Propiedades espectroscópicas de compuestos inorgánicos y organometálicos . Real Sociedad de Química. págs. 516–517. ISBN 9780854044269. Consultado el 30 de septiembre de 2014 .
- ^ Fedoroff, Basil T; Sheffield, Oliver E. Enciclopedia de Explosivos y Artículos relacionados Vol 10 de 10 U a Z . 10 . pag. V4.
- ^ a b c Brandán, SA; A. Ben Altabef, EL Varetti; Varetti, EL (1995). "Espectros vibratorios y electrónicos del nitrato de vanadilo, VO (NO3) 3". Spectrochimica Acta Part A: Espectroscopía molecular y biomolecular . 51 (4): 669–675. Código bibliográfico : 1995AcSpA..51..669B . doi : 10.1016 / 0584-8539 (94) 00154-4 . ISSN 1386-1425 .
- ^ Aitken, R. Alan; Alajarin, Mateo; Allen, DW; Mikael Begtrup; Daniel Bellus; J. Berna-Canovas; H. Boeckemeier; Stefan Bräse; IR Butler; José Chiara; Henri-J. Cristau; I. Gorrell; D. Keck; Terence Kee; Carmen López-Leonardo; T. Muller; Patrick J. Murphy; Patrick O'Leary; Beate Priewisch; LK Rasmussen; Karola Rück-Braun; Bjoern Schlummer; Andreas Schmidt; Paul James Stevenson; JC Tebby; David Virieux (14 de mayo de 2014). Ciencia de síntesis: métodos Houben-Weyl de transformaciones moleculares vol. 31b: Arene-X (X = N, P) . Georg Thieme Verlag. pag. 1215. ISBN 9783131720719. Consultado el 29 de septiembre de 2014 .
Otra lectura
- Gmelin, Syst No 48, Teil A y Teil B (Lieferung 1 y 2) (1967); Teil A (Lieferung 1) y Teil A (Lieferung 2) (1968); y Erganzungwerk (Band2) (1971)
- M. Schmeisser, "Chemical Abstracts", (1955), 49, 10873
- L. Bretherick, Ed, "Peligros en el laboratorio químico", Royal Society of Chemistry, Londres, Engl (1979), pág. 1160
