Ticarcilina - Ticarcillin
 | |
| Datos clinicos | |
|---|---|
| AHFS / Drugs.com | Monografía |
| MedlinePlus | a685037 |
Categoría de embarazo |
|
| Vías de administración |
Intravenoso |
| Código ATC | |
| Estatus legal | |
| Estatus legal | |
| Datos farmacocinéticos | |
| Enlace proteico | 45% |
| Vida media de eliminación | 1,1 horas |
| Excreción | Renal |
| Identificadores | |
| |
| Número CAS | |
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| CHEBI | |
| CHEMBL | |
| Tablero CompTox ( EPA ) | |
| Tarjeta de información ECHA |
100.047.451 |
| Datos químicos y físicos | |
| Fórmula | C 15 H 16 N 2 O 6 S 2 |
| Masa molar | 384,42 g · mol −1 |
| Modelo 3D ( JSmol ) | |
| |
| |
| (verificar) | |
La ticarcilina es una carboxipenicilina . Casi siempre se vende y se usa en combinación con clavulanato como ticarcilina / ácido clavulánico . Debido a que es una penicilina, también pertenece a la clase más amplia de antibióticos betalactámicos . Su principal uso clínico es como antibiótico inyectable para el tratamiento de bacterias Gram negativas , en particular Pseudomonas aeruginosa y Proteus vulgaris . También es uno de los pocos antibióticos capaces de tratar las infecciones por Stenotrophomonas maltophilia .
Se presenta en forma de polvo blanco o amarillo pálido. Es muy soluble en agua, pero debe disolverse solo inmediatamente antes de su uso para evitar su degradación.
Fue patentado en 1963.
Mecanismo de acción
Las propiedades antibióticas de la ticarcilina surgen de su capacidad para prevenir la reticulación del peptidoglicano durante la síntesis de la pared celular , cuando las bacterias intentan dividirse , provocando la muerte celular.
La ticarcilina, como la penicilina , contiene un anillo β-lactámico que puede ser escindido por las beta-lactamasas , lo que resulta en la inactivación del antibiótico. Las bacterias que pueden expresar β-lactamasas son, por tanto, resistentes a los antibióticos β-lactámicos. Debido, al menos en parte, al anillo β-lactámico común, la ticarcilina puede causar reacciones en pacientes alérgicos a la penicilina. La ticarcilina también suele combinarse con un inhibidor de la β-lactamasa , como el ácido clavulánico ( co-ticarclav ).
Otros usos
En biología molecular , la ticarcilina se utiliza como alternativa a la ampicilina para probar la captación de genes marcadores en bacterias. Previene la aparición de colonias satélites que se producen cuando la ampicilina se degrada en el medio. También se utiliza en biología molecular vegetal para matar Agrobacterium , que se utiliza para administrar genes a las células vegetales.
Dosificación y administración
La ticarcilina no se absorbe por vía oral, por lo que debe administrarse mediante inyección intravenosa o intramuscular.
Nombres comerciales y preparados
- Ticarcillin: Ticar fue comercializado anteriormente por Beecham , luego SmithKline Beecham hasta 1999, cuando se fusionó con Glaxo para formar GlaxoSmithKline ; ya no está disponible en el Reino Unido. La distribución en Estados Unidos cesó en 2004. Ticar fue reemplazado por Timentin.
Sin embargo, Timentin contiene clavulanato a diferencia de Ticar
- Ticarcilina / clavulanato : Timentin, en Australia, el Reino Unido y los EE. UU., Fue comercializado por Beecham, luego GlaxoSmithKline.
Síntesis
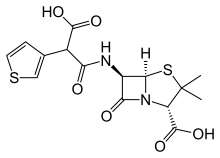
La carbenicilina se usa en la clínica principalmente debido a su baja toxicidad y su utilidad en el tratamiento de infecciones del tracto urinario debidas a especies susceptibles de Pseudomonas . Su baja potencia, baja actividad oral y susceptibilidad a las betalactamasas bacterianas lo hacen vulnerable al reemplazo por agentes sin estos déficits. Un contendiente en esta carrera es la ticaricilina. Su origen dependía del hecho bien conocido de que un azufre divalente es aproximadamente equivalente a un grupo vinilo (cf. metiopropamina , sufentanil , pizotyline , etc.).
Una síntesis comenzó haciendo el éster monobencílico del ácido 3-tienilmalónico, convirtiéndolo en el cloruro de ácido con SOCl2 y condensándolo con ácido 6-aminopenicilánico ( 6-APA ). La hidrogenólisis (Pd / C) completó la síntesis de ticarcilina.