Cetobemidona - Ketobemidone
 | |
| Datos clinicos | |
|---|---|
| Nombres comerciales | Ketogan |
| Otros nombres | Cetobemidona, Cliradon, Cymidon, Ketogan, Ketorax |
| AHFS / Drugs.com | Nombres internacionales de medicamentos |
| Vías de administración |
Por vía oral , rectal , intravenosa |
| Código ATC | |
| Estatus legal | |
| Estatus legal | |
| Datos farmacocinéticos | |
| Biodisponibilidad | 34∼40% (oral), 44% (rectal) |
| Vida media de eliminación | 2-4 horas |
| Duración de la acción | 3-5 horas |
| Identificadores | |
| |
| Número CAS | |
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| CHEMBL | |
| Tablero CompTox ( EPA ) | |
| Tarjeta de información ECHA |
100.006.748 |
| Datos químicos y físicos | |
| Fórmula | C 15 H 21 N O 2 |
| Masa molar | 247,338 g · mol −1 |
| Modelo 3D ( JSmol ) | |
| |
| |
|
| |
La cetobemidona , vendida bajo la marca Ketogan entre otros, es un poderoso analgésico opioide sintético . Su eficacia contra el dolor está en el mismo rango que la morfina , y también tiene algunas propiedades antagonistas del NMDA impartidas, en parte, por su metabolito norketobemidona. Esto puede hacer que sea útil para algunos tipos de dolor que no responden bien a otros opioides. Se comercializa en Dinamarca , Islandia , Noruega y Suecia y se utiliza para el dolor intenso.
Historia
La cetobemidona fue sintetizada por primera vez en 1942 por Eisleb y sus colegas, en el laboratorio de IG Farbenindustrie en Hoechst durante la Segunda Guerra Mundial. El primer estudio en humanos se publicó en 1946 y se introdujo en la medicina clínica poco después. No estaba en uso clínico en los Estados Unidos cuando se promulgó la Ley de Sustancias Controladas de 1970 y se asignó al Anexo I con un ACSCN de 9628. A partir de 2013, la DEA no asignó una cuota de fabricación anual.
Pfizer fabrica cetobemidona con los nombres comerciales Ketogan y Ketorax. Está disponible en tabletas , supositorios y líquido inyectable. Existe una formulación de liberación sostenida, vendida como Ketodur, en algunos países que contiene 10 o 25 mg de cetobemidona.
Farmacología
Los experimentos con ex adictos indicaron que era bastante adictivo y en dosis altas, en comparación con otros opioides, puede haber aumentado el potencial de abuso en los adictos a opioides anteriores y actuales. Si bien, primero se sugirió cierto esfuerzo para redactar una resolución que instara a los gobiernos a detener la fabricación y el uso de cetobemidona. Este resultado no estaba de acuerdo con las observaciones clínicas, y otro estudio en 1958 no lo encontró más adictivo que la morfina. Ese estudio notó que mientras que para la morfina la dosis de euforia es la misma que para la analgesia, para la cetobemidona la dosis de analgésico estaba muy por debajo de la dosis de euforia. Por lo tanto, incluso en comparación con la morfina, la cetobemidona puede ser mucho más efectiva sin causar una euforia significativa y esto tiene un menor riesgo de adicción bajo la supervisión de un médico calificado. La cetobemidona se usa principalmente en los países escandinavos , y Dinamarca encabeza las estadísticas.
La analgesia después de 5 a 10 mg por vía oral o de 5 a 7,5 mg por vía intravenosa dura de 3 a 5 horas. La cetobemidona también está disponible en preparaciones con espasmolítico , que puede mejorar la analgesia.
Metabolismo
La cetobemidona se metaboliza principalmente por conjugación del grupo hidroxilo fenólico y por N- desmetilación. Solo alrededor del 13-24% se excreta inalterado después de la administración intravenosa.
Química
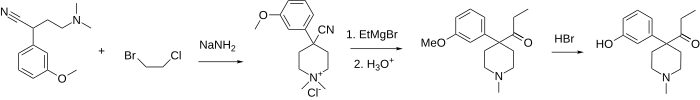
La cetobemidona es 1-metil-4- (3-hidroxifenil) -4-propionilpiperidina. Por lo general, está disponible como clorhidrato , que es un polvo blanco. Se sintetiza alquilando (3-metoxifenil) acetonitrilo con bis (2-cloroetil) metilamina , seguido de reacción con bromuro de etilmagnesio y finalmente O-desmetilación con ácido bromhídrico .
Debido a la fuerte naturaleza vesicante de la bis (2-cloroetil) metilamina, se han desarrollado muchas otras rutas para obtener cetobemidona. Una ruta representada a continuación consiste en alquilar primero el mismo (3-metoxifenil) acetonitrilo con 2-cloro- N , N -dimetiletilamina o 2-cloro- N -bencil- N -metiletilamina. A continuación, esas aminas se alquilan una vez más utilizando una mezcla de 1-bromo-2-cloroetano, completando así el anillo de piperidina y obteniendo una sal de amonio cuaternario, que se puede descuaternizar utilizando sal de tiofenol (para N , N- dimetilamonio) o hidrogenación catalítica ( para ambos compuestos) a una 4- (3-metoxifenil) -4-ciano-1-metil-piridina común. El último produce cetobemidona después de la reacción de Grignard con bromuro de etilmagnesio y escisión con éter.
Ver también
Referencias
enlaces externos
- "Cetobemidona" . Portal de información sobre medicamentos . Biblioteca Nacional de Medicina de EE. UU.