Escudo de Dalkon - Dalkon Shield
El Dalkon Shield era un dispositivo intrauterino anticonceptivo (DIU) desarrollado por Dalkon Corporation y comercializado por AH Robins Company. Se descubrió que el Dalkon Shield causaba lesiones graves a un porcentaje desproporcionadamente grande de mujeres, lo que finalmente dio lugar a numerosas demandas, en las que los jurados otorgaron millones de dólares en daños compensatorios y punitivos.
Historia
En 1970, AH Robins Company adquirió Dalkon Shield de Dalkon Corporation, fundada por Hugh J. Davis, MD. La Dalkon Corporation tenía solo cuatro accionistas: los inventores Davis e Irwin Lerner, su abogado Robert Cohn y Thad J. Earl. MD, médico en Defiance, Ohio . En 1971, Dalkon Shield entró al mercado, comenzando en los Estados Unidos y Puerto Rico , encabezado por una gran campaña de marketing. En su apogeo, alrededor de 2.8 millones de mujeres usaron el Dalkon Shield en los EE. UU.
En el momento de su introducción, Dalkon Shield se promocionó como una alternativa más segura en comparación con las píldoras anticonceptivas , que en ese momento eran objeto de muchas preocupaciones de seguridad. Los informes iniciales en la literatura médica plantearon dudas sobre si su eficacia en la prevención del embarazo y la tasa de expulsión eran tan buenas como las afirmadas por el fabricante, pero no detectaron la tendencia del dispositivo a causar abortos sépticos y otras infecciones graves.
En junio de 1973, los Centros para el Control y la Prevención de Enfermedades (CDC) llevaron a cabo una encuesta de 34,544 médicos con prácticas en ginecología u obstetricia sobre mujeres que habían sido hospitalizadas o habían fallecido por complicaciones relacionadas con el uso de un DIU en los 6 meses anteriores. Respondieron un total de 16.994 médicos, lo que arrojó 3502 informes de casos únicos de mujeres hospitalizadas en los primeros 6 meses de 1973. Según la tasa de respuesta de la encuesta, los CDC estimaron que ocurrieron un total de 7,900 hospitalizaciones relacionadas con el DIU durante este período de 6 meses. Con base en una estimación de 3,2 millones de usuarios de DIU, los CDC estimaron una tasa anual de hospitalización relacionada con el dispositivo de 5 por 1000 usuarios de DIU. La encuesta también proporcionó 5 informes de muertes relacionadas con dispositivos, cuatro de ellos relacionados con infecciones graves. Uno de los cinco estaba asociado con el Escudo de Dalkon. Con base en estos datos, los CDC estimaron una tasa de mortalidad relacionada con el DIU de 3 por millón de usuarios por año de uso, que comparó favorablemente con los riesgos de mortalidad asociados con el embarazo y otras formas de anticoncepción. Es importante destacar que la encuesta mostró que Dalkon Shield se asoció con una mayor tasa de complicaciones asociadas al embarazo que conducen a la hospitalización.
En 1974, aproximadamente 2,5 millones de mujeres habían recibido el dispositivo intrauterino Dalkon. En junio de ese año, el director médico de AH Robins publicó una carta al editor del British Medical Journal indicando que la empresa estaba al tanto de un "aparente aumento en el número de casos de abortos sépticos", incluidas 4 muertes, pero afirmando que "No hay evidencia de una relación directa de causa y efecto entre el uso del escudo Dalkon y la aparición de septicemia ". La carta recomendó precauciones, incluidas las pruebas de embarazo para las mujeres que perdieron su período y la extracción inmediata del dispositivo en las mujeres que estaban embarazadas. En octubre de 1974, se publicó una serie de cuatro informes de casos de embarazos sépticos en la revista Obstretics and Gynecology ". En 1975, los CDC publicaron un estudio que asociaba el Dalkon Shield con un mayor riesgo de muerte espontánea relacionada con el aborto en comparación con otros DIU.
Hasta 200,000 mujeres hicieron reclamos contra la compañía AH Robins, principalmente relacionados con reclamos asociados con enfermedad inflamatoria pélvica y pérdida de fertilidad. La empresa finalmente se declaró en quiebra. Los representantes de la compañía argumentaron que las infecciones pélvicas tienen una amplia variedad de causas y que el Dalkon Shield no era más peligroso que otras formas de control de la natalidad. Los abogados de los demandantes argumentaron que las mujeres que representaban serían saludables y fértiles hoy si no fuera por el dispositivo. Los científicos de los CDC afirmaron que ambos argumentos tienen mérito.
Secuelas
Se presentaron más de 300,000 demandas contra AH Robins Company, el caso de responsabilidad extracontractual más grande desde el asbesto . El juez federal, Miles W. Lord , atrajo comentarios públicos por sus juicios, imposición de responsabilidad personal y reproches públicos de los jefes de la empresa. El costo de los litigios y acuerdos (estimado en miles de millones de dólares) llevó a la compañía a solicitar la protección por bancarrota del Capítulo 11 en 1985. Como resultado, Robins vendió la compañía a American Home Products (ahora Wyeth ).
En 1976, las Enmiendas de Dispositivos Médicos a la Ley de Alimentos, Medicamentos y Cosméticos ordenaron a la Administración de Alimentos y Medicamentos de los Estados Unidos, por primera vez, exigir pruebas y aprobación de "dispositivos médicos", incluidos los DIU.
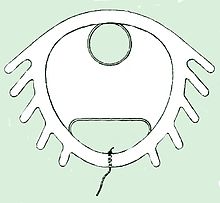
El Dalkon Shield se hizo famoso por su grave defecto de diseño: un hilo multifilamento poroso sobre el que las bacterias podían viajar al útero de las usuarias, provocando sepsis, lesiones, abortos espontáneos y la muerte. Los dispositivos intrauterinos modernos (DIU) utilizan hilos de monofilamento, que no representan este grave riesgo para los usuarios.
Referencias
Bibliografía
- Szaller, Jim (invierno de 1999). "Viaje de 25 años de un abogado: la saga del escudo de Dalkon" . Juicio de Ohio . 9 (4). Archivado desde el original (reimpresión) el 13 de mayo de 2006 . Consultado el 17 de agosto de 2006 . - Equipo legal de Chronicles sobre la participación de Brown & Szaller en el Litigio de Dalkon Shield.
- Speroff, L .; Vidrio, RH; Kase, NG (1999). Endocrinología Clínica Ginecológica e Infertilidad (6ª ed.). Lippincott, Williams y Wilkins. pag. 976. ISBN 978-0-683-30379-7.
- Gordon, Meryl (20 de febrero de 1999). "Un acuerdo en efectivo, pero sin disculpas" . New York Times . Consultado el 17 de agosto de 2006 .
- Sivin, I. (1993). "Otra mirada al Dalkon Shield: el metanálisis subraya sus problemas". Anticoncepción . 48 (1): 1–12. doi : 10.1016 / 0010-7824 (93) 90060-k . PMID 8403900 .
-
Anselmi, Katherine Kaby (1994). "La respuesta de las mujeres al trauma reproductivo secundario a la iatrogénesis anticonceptiva: un enfoque fenomenológico para el caso de Dalkon Shield" (Resumen) : 1–226. Cite journal requiere
|journal=( ayuda ) - Disertación - "Se aprueba el plan de Robins" . New York Times . Associated Press. 17 de junio de 1989.
- Shereff, Ruth (13 de febrero de 1989). "Cómo recompensar a los criminales". La Nación . 248 (6).
Libros
- Bacigal, Ronald J. (1990). Los límites del litigio: la controversia del escudo de Dalkon . Durham, Carolina del Norte: Carolina Academic Press. ISBN 0890893918.
- Engelmayer, Sheldon D. (22 de septiembre de 1985). "Justicia del Señor: la guerra de un juez contra el infame escudo de Dalkon" (New York Times Review) . The New York Times . Nueva York. ISBN 978-0-385-23051-3. Consultado el 30 de abril de 2010 .
- Grant, Nicole J. (1992). La venta de anticonceptivos: el caso Dalkon Shield, la sexualidad y la autonomía de la mujer . Columbus: Prensa de la Universidad Estatal de Ohio. ISBN 978-0814205723.
- Hawkins, Mary E. (1997). Sin blindaje: el costo humano del escudo de Dalkon . Toronto: Prensa de la Universidad de Toronto. ISBN 0802008763.
- Hicks, Karen M. (1994). Sobrevivir al DIU del escudo de Dalkon: Mujeres contra la industria farmacéutica . Nueva York: Teachers College Press. ISBN 0807762717.
-
Mintz, Morton (1985). A cualquier precio: codicia corporativa, mujeres y el escudo de Dalkon . Nueva York: Pantheon. ISBN 0394548469.
- Resumen: Morton Mintz (15 de enero de 1986). "Un crimen contra las mujeres: AH Robins y el escudo de Dalkon" . Monitor multimedia . 7 (1). - Incluye el texto completo de la declaración del juez presidente Miles Lord a Clairbone Robins, et al., En la parte inferior.
- Revisado y resumido por: Tamar Lewin (12/01/1986). "¿Qué normas para la delincuencia empresarial?" . New York Times .
- Perry, Susan y Dawson, Jim (1985). Pesadilla: Mujeres y el escudo de Dalkon . Nueva York: Macmillan. ISBN 0025959301.
- Sobol, Richard B. (1991). Doblando la ley: la historia de la quiebra de Dalkon Shield . Chicago: Prensa de la Universidad de Chicago. ISBN 0226767523.
- Stern, Gerald M. (1976). El desastre de Buffalo Creek . Nueva York: Random House. ISBN 0394403908.