Proteína adaptadora de transporte vesicular - Vesicular transport adaptor protein
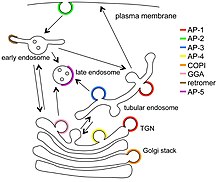
Las proteínas adaptadoras del transporte vesicular son proteínas involucradas en la formación de complejos que funcionan en el tráfico de moléculas de una ubicación subcelular a otra. Estos complejos concentran las moléculas de carga correctas en vesículas que brotan o salen de un orgánulo y viajan a otra ubicación, donde se entrega la carga. Si bien se han resuelto algunos de los detalles de cómo estas proteínas adaptadoras logran su especificidad de tráfico, todavía queda mucho por aprender.
Existen varios trastornos humanos asociados con defectos en los componentes de estos complejos, incluidas las enfermedades de Alzheimer y Parkinson .
Las proteinas
La mayoría de las proteínas adaptadoras son heterotetrámeros . En los complejos AP, hay dos proteínas grandes ( ∼ 100 k D ) y dos proteínas más pequeñas. Una de las proteínas grandes se denomina β ( beta ), con β1 en el complejo AP-1, β2 en el complejo AP-2 , y así sucesivamente. La otra proteína grande tiene diferentes designaciones en los diferentes complejos. En AP-1 se llama γ ( gamma ), AP-2 tiene α ( alfa ), AP-3 tiene δ ( delta ), AP-4 tiene ε ( épsilon ) y AP-5 tiene ζ ( zeta ). Las dos proteínas más pequeñas son una subunidad media denominada μ ( mu ∼50 kD) y una subunidad pequeña σ ( sigma ∼20 kD), y nombradas del 1 al 5 correspondientes a los 5 complejos AP. Componentes de COPI (cop uno) un coatomer , y TSET (T-set) una membrana de tráfico de complejo tienen heterotetrámeros similares de los complejos AP.
Retromer no está estrechamente relacionado, se ha revisado y sus proteínas no se describirán aquí. Las GGA (localización de Golgi, homología del dominio del oído de gamma-adaptina, proteínas de unión a ARF) son un grupo de proteínas relacionadas (tres en humanos) que actúan como proteínas adaptadoras de clatrina monoméricas en varios tráficos importantes de vesículas de membrana , pero no son similares a ninguna de las los complejos AP y no se discutirán en detalle en este artículo. Stonins (que no se muestran en la figura principal) también son monómeros similares en algunos aspectos a GGA y tampoco se discutirán en detalle en este artículo.
Los PTB son dominios de proteínas que incluyen NUMB , DAB1 y DAB2 . Epsin y AP180 en el dominio ANTH son otras proteínas adaptadoras que se han revisado.
Un importante complejo de transporte, COPII , no se muestra en la figura principal. El complejo COPII es un heterohexámero, pero no está estrechamente relacionado con los complejos AP / TSET. Las proteínas individuales del complejo COPII se llaman SEC proteínas, debido a que están codificadas por los genes identificados en la SEC mutantes retory de levadura. Un aspecto especialmente interesante de COPII es que puede formar vesículas y túbulos esféricos típicos para transportar moléculas grandes como precursores de colágeno , que no pueden caber dentro de vesículas esféricas típicas. La estructura de la COPII se ha discutido en un artículo abierto y no será un tema central de este artículo. Estos son ejemplos del conjunto mucho mayor de adaptadores de carga.
Consideraciones evolutivas
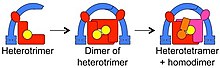
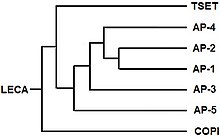
El ancestro común más reciente (MRCA) de los eucariotas debe haber tenido un mecanismo para el tráfico de moléculas entre sus endomembranas y orgánulos , y se ha informado de la probable identidad del complejo adaptador involucrado. Se cree que el MRCA tenía 3 proteínas involucradas en el tráfico y que formaban un heterotrímero. Ese heterotrímero a continuación se "dimerizó" para formar un complejo de 6 miembros. Los componentes individuales cambiaron además en los complejos actuales, en el orden mostrado, siendo AP1 y AP2 los últimos en divergir.
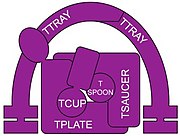
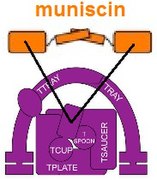
Además, un componente de TSET, una muniscina también conocida como proteína TCUP, parece haber evolucionado hasta convertirse en parte de las proteínas de los opistocontes (animales y hongos ). Partes de los complejos AP se han convertido en partes de las proteínas GGA y stonina. Existe evidencia que indica que partes del complejo de poros nucleares y COPII pueden estar relacionadas evolutivamente.
Formación de vesículas de transporte.
El tipo de vesícula mejor caracterizado es la vesícula recubierta de clatrina (CCV). La formación de una vesícula COPII en el retículo endoplásmico y su transporte al cuerpo de Golgi . La participación del heterotetrámero de COPI es similar a la de la situación AP / clatrina, pero la capa de COPI no está estrechamente relacionada con las capas de las vesículas CCV o COPII. AP-5 está asociado con 2 proteínas, SPG11 y SPG15 , que tienen cierta similitud estructural con la clatrina y pueden formar la capa alrededor del complejo AP-5, pero se desconoce la ultraestructura de esa capa. Se desconoce el pelaje de AP-4.
Una característica casi universal del ensamblaje de la capa es el reclutamiento de los diversos complejos adaptadores a la membrana "donante" por la proteína Arf1 . La única excepción conocida es AP-2, que es reclutado por un lípido de la membrana plasmática en particular .
Otra característica casi universal del ensamblaje de abrigos es que los adaptadores se reclutan primero y luego reclutan a los abrigos. La excepción es COPI, en la que las 7 proteínas se reclutan en la membrana como heptámero.
Como se ilustra en la imagen adjunta, la producción de una vesícula recubierta no es instantánea, y una fracción considerable del tiempo de maduración se usa para hacer interacciones "abortivas" o "inútiles" hasta que ocurren suficientes interacciones simultáneamente para permitir que la estructura continúe desarrollándose. .
El último paso en la formación de una vesícula de transporte es "pellizcar" de la membrana donante. Esto requiere energía, pero incluso en el caso bien estudiado de los CCV, no todos requieren dinamina . La ilustración adjunta muestra el caso de los CCV AP-2, sin embargo, los CCV AP-1 y AP-3 no usan dinamina.
Selección de moléculas de carga
Qué moléculas de carga se incorporan a un tipo particular de vesícula depende de interacciones específicas. Algunas de estas interacciones son directamente con complejos AP y algunas son indirectamente con "adaptadores alternativos", como se muestra en este diagrama . Como ejemplos, las proteínas de membrana pueden tener interacciones directas, mientras que las proteínas que son solubles en el lumen del orgánulo donante se unen indirectamente a los complejos AP al unirse a proteínas de membrana que atraviesan la membrana y se unen en su extremo lumenal a la molécula de carga deseada. Las moléculas que no deberían incluirse en la vesícula parecen estar excluidas por "apiñamiento molecular".
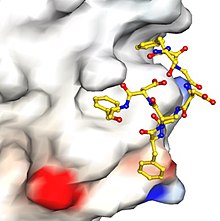
Las "señales" o "motivos" de aminoácidos en las proteínas de carga que interactúan con las proteínas adaptadoras pueden ser muy breves. Por ejemplo, un ejemplo bien conocido es el motivo de dileucina , en el que un residuo de aminoácido leucina (aa) es seguido inmediatamente por otro residuo de leucina o isoleucina . Un ejemplo aún más simple es la señal basada en tirosina , que es YxxØ (en y residuo de colofonia separado por 2 residuos de aa de otro residuo de aa hidrófobo y voluminoso ). La figura adjunta muestra cómo una pequeña parte de una proteína puede interactuar específicamente con otra proteína, por lo que estos motivos de señalización cortos no deberían sorprendernos. El tipo de comparaciones de secuencias utilizadas, en parte, para definir estos motivos.
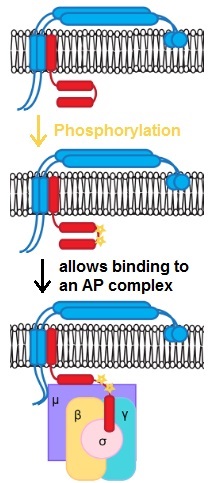
En algunos casos, post- traduccionales modificaciones, tales como fosforilaciones (mostrado en la figura) son importantes para el reconocimiento de carga.
Enfermedades
Se han revisado las enfermedades adaptadoras .
Los AP-2 / CCV están implicados en la hipercolesterolemia autosómica recesiva a través de la proteína adaptadora del receptor de lipoproteínas de baja densidad 1 asociada .
Retromer participa en el reciclaje de componentes de la membrana plasmática. La importancia de ese reciclaje en una sinapsis se insinúa en una de las figuras de la galería. Hay al menos 3 formas en las que la disfunción del retrómero puede contribuir a los trastornos cerebrales, incluidas las enfermedades de Alzheimer y Parkinson.
AP-5 es el complejo descrito más recientemente, y una razón que apoya la idea de que es un auténtico complejo adaptador es que está asociado con paraplejía espástica hereditaria , al igual que AP-4. AP-1 está relacionado con el síndrome de MEDNIK . AP-3 está relacionado con el síndrome de Hermansky-Pudlak . La COPI está relacionada con una enfermedad autoinmune . La COPII está relacionada con la displasia craneo-lentículo-sutural . Una de las proteínas GGA puede estar involucrada en la enfermedad de Alzheimer.