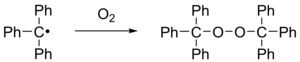Radical trifenilmetilo - Triphenylmethyl radical
|
|

|
|
| Nombres | |
|---|---|
|
Nombre IUPAC preferido
Trifenilmetilo |
|
| Identificadores | |
|
Modelo 3D ( JSmol )
|
|
| ChemSpider | |
|
PubChem CID
|
|
|
|
|
|
| Propiedades | |
| C 19 H 15 | |
| Masa molar | 243,329 g · mol −1 |
|
Salvo que se indique lo contrario, los datos se proporcionan para materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa). |
|
|
|
|
| Referencias de Infobox | |
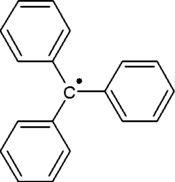
El radical trifenilmetilo (a menudo acortado a radical tritilo ) es un radical persistente y el primer radical jamás descrito en química orgánica .
Preparación y propiedades
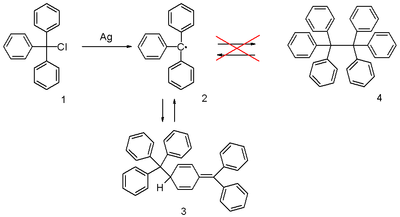
Puede prepararse por homólisis del cloruro de trifenilmetilo 1 con un metal como plata o zinc en benceno o éter dietílico . El radical 2 forma un equilibrio químico con el dímero de tipo quinoide 3 ( dímero de Gomberg ). En benceno, la concentración del radical es del 2%.
Las soluciones que contienen el radical son amarillas ; cuando se eleva la temperatura de la solución, el color amarillo se vuelve más intenso a medida que el equilibrio se desplaza a favor del radical (de acuerdo con el principio de Le Châtelier ).
Cuando se expone al aire, el radical se oxida rápidamente al peróxido y el color de la solución cambia de amarillo a incoloro. Asimismo, el radical reacciona con el yodo para dar yoduro de trifenilmetilo.
Mientras que el radical tritilo forma un dímero de quinoide, sus derivados con el patrón de sustitución apropiado forman dímeros con una estructura de hexafeniletano. Los estudios de rayos X dan una longitud de enlace de 1,67 Å para hexakis (3,5-di- t- butilfenil) etano. Los cálculos teóricos en un nivel muy alto de teoría indican que la atracción de van der Waals entre los grupos terc- butilo crea un mínimo potencial que está ausente en la molécula no sustituida. Se han informado otros derivados como el dímero de quinoide
Historia
El radical fue descubierto por Moses Gomberg en 1900 en la Universidad de Michigan . Trató de preparar hexofeniletano a partir de cloruro de trifenilmetilo y zinc en benceno en una reacción de Wurtz y descubrió que el producto, basado en su comportamiento frente al yodo y el oxígeno, era mucho más reactivo de lo previsto. La estructura descubierta se utilizó en el desarrollo de la espectroscopia ESR y fue confirmada por ella.
La estructura de quinoide correcta para el dímero se sugirió ya en 1904, pero esta estructura fue abandonada poco después por la comunidad científica a favor del hexaphenylethane ( 4 ). Posteriormente, tomó hasta 1968 para su redescubrimiento cuando los investigadores de la Vrije Universiteit Amsterdam publicaron datos de RMN de protones .
Ver también
- Hexafluorofosfato de trifenilmetilo
- Trifenilmetano
- Tinte de triarilmetano
- Radicales trivalentes del grupo 14
Referencias
enlaces externos
- Molécula del mes , junio de 1997
- Radical trifenilmetilo: propiedades y síntesis