Tetracloroaluminato - Tetrachloroaluminate

|
|
| Nombres | |
|---|---|
|
Nombre IUPAC
Tetracloroaluminato (1–)
|
|
|
Nombre IUPAC sistemático
Tetracloroaluminato (1-) |
|
Otros nombres
|
|
| Identificadores | |
|
Modelo 3D ( JSmol )
|
|
| CHEBI | |
| ChemSpider | |
| 2297 | |
|
PubChem CID
|
|
|
|
|
|
| Propiedades | |
| AlCl 4 - | |
| Masa molar | 168,78 g · mol −1 |
| Estructura | |
| T d | |
| Tetraédrico | |
| Hibridación | sp 3 |
|
Salvo que se indique lo contrario, los datos se proporcionan para materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa). |
|
|
|
|
| Referencias de Infobox | |
Tetracloroaluminato [AlCl 4 ] - es un anión formado a partir de aluminio y cloro . El anión tiene una forma tetraédrica , similar al tetracloruro de carbono, donde el carbono se reemplaza por aluminio. Algunos tetracloroaluminatos son solubles en disolventes orgánicos, creando una solución iónica no acuosa, lo que los hace adecuados como componente de electrolitos para baterías. Por ejemplo, el tetracloroaluminato de litio se usa en algunas baterías de litio .
Formación
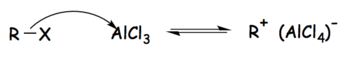
Los iones de tetracloroaluminato se forman como productos intermedios en las reacciones de Friedel-Crafts cuando se utiliza cloruro de aluminio como catalizador. En el caso de la alquilación de Friedel - Crafts, la reacción se puede dividir en tres pasos de la siguiente manera:
Paso 1: El haluro de alquilo reacciona con el ácido de Lewis fuerte para formar un electrófilo activado compuesto por el ion tetracloroaluminato y el grupo alquilo.
Paso 2: El anillo aromático ( benceno en este caso) reacciona con el electrófilo activado formando un carbocatión de alquilbenzenio.
Paso 3: El carbocatión de alquilbenceno reacciona con un anión tetracloroaluminato, regenerando el anillo aromático y el ácido de Lewis y formando ácido clorhídrico (HCl).
Un mecanismo similar ocurre en la acilación de Friedel - Crafts.