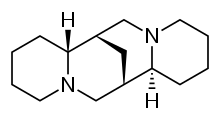
Esparteína - Sparteine
 | |
| Datos clinicos | |
|---|---|
| Otros nombres | (6 R , 8 S , 10 R , 12 S ) -7,15-diazatetraciclo [7.7.1.0 2,7 .0 10,15 ] heptadecano |
| AHFS / Drugs.com | Nombres internacionales de medicamentos |
| Código ATC | |
| Identificadores | |
| |
| Número CAS | |
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| CHEBI | |
| CHEMBL | |
| Tablero CompTox ( EPA ) | |
| Tarjeta de información ECHA |
100.001.808 |
| Datos químicos y físicos | |
| Fórmula | C 15 H 26 N 2 |
| Masa molar | 234,387 g · mol −1 |
| Modelo 3D ( JSmol ) | |
| Densidad | 1,02 g / cm 3 |
| Punto de fusion | 30 ° C (86 ° F) |
| Punto de ebullición | 325 ° C (617 ° F) |
| solubilidad en agua | 3,04 mg / ml (20 ° C) |
| |
| |
|
| |
La esparteína es un agente antiarrítmico de clase 1a ; un bloqueador de los canales de sodio. Es un alcaloide y se puede extraer de la escoba escocesa . Es el alcaloide predominante en Lupinus mutabilis y se cree que quela los cationes bivalentes calcio y magnesio . No está aprobado por la FDA para uso humano como agente antiarrítmico y no está incluido en la clasificación de medicamentos antiarrítmicos de Vaughan Williams .
También se utiliza como ligando quiral en química orgánica , especialmente en síntesis que involucran reactivos de organolitio .
Biosíntesis
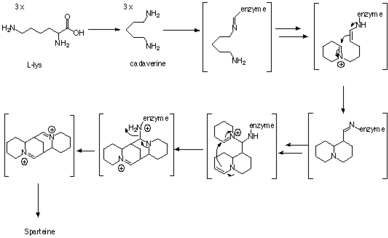
La esparteína es un alcaloide de lupino que contiene un sistema de anillo tetracíclico bis-quinolizidina derivado de tres cadenas C 5 de lisina , o más específicamente, L-lisina. El primer intermedio en la biosíntesis es la cadaverina , el producto de descarboxilación de la lisina catalizada por la enzima lisina descarboxilasa (LDC). Se utilizan tres unidades de cadaverina para formar el esqueleto de quinolizidina. El mecanismo de formación se ha estudiado enzimáticamente, así como con experimentos de trazadores, pero la ruta exacta de síntesis aún no está clara.
Los estudios de trazadores que utilizan cadaverina doblemente marcada con 13 C- 15 N han demostrado que tres unidades de cadaverina se incorporan a la esparteína y dos de los enlaces CN de dos de las unidades de cadaverina permanecen intactos. Las observaciones también se han confirmado usando experimentos de marcado de 2 H NMR.
La evidencia enzimática mostró entonces que las tres moléculas de cadaverina se transforman en el anillo de quinolizidina a través de intermedios unidos a enzimas, sin la generación de intermedios libres. Originalmente, se pensó que la conversión de cadaverina en el aldehído correspondiente, 5-aminopentanal, estaba catalizada por la enzima diamino oxidasa. El aldehído luego convierte espontáneamente a la correspondiente base de Schiff, Δ 1 -piperideine. El acoplamiento de dos moléculas se produce entre los dos tautómeros de Δ 1 -piperideína en una reacción de tipo aldol. A continuación, la imina se hidroliza al aldehído / amina correspondiente. A continuación, la amina primaria se oxida a un aldehído seguido de la formación de la imina para producir el anillo de quinolizidina.
Vía 17-oxosparteína sintasa
La evidencia enzimática más reciente ha indicado la presencia de 17-oxosparteína sintasa (OS), una enzima transaminasa. La cadaverina desaminada no se libera de la enzima, por lo que se puede suponer que la enzima cataliza la formación del esqueleto de quinolizidina de forma canalizada. La 7-oxosparteína requiere cuatro unidades de piruvato como aceptores de NH 2 y produce cuatro moléculas de alanina. Tanto la lisina descarboxilasa como la enzima formadora de esqueleto de quinolizidina están localizadas en los cloroplastos.
Ver también
Referencias
- ^ Dewick PM (2009). Productos Naturales Medicinales, 3er. Ed . Wiley. pags. 311.
- ^ Golebiewski WM, Spenser ID (1988). "Biosíntesis de los alcaloides del lupino. II. Esparteína y lupanina" . Revista canadiense de química . 66 (7): 1734-1748. doi : 10.1139 / v88-280 .
- ^ Rana J, Robins DJ (1983). "Biosíntesis de alcaloides de quinolizidina: incorporación de [1-amino-15 N, 1-13 C] cadaverina en esparteína". Revista de la Sociedad Química, Comunicaciones químicas (22): 1335–6. doi : 10.1039 / c39830001335 .
-
^ Fraser AM, Robins DJ (1984). J. Chem. Soc., Chem. Comun . 22 : 1147–9. Falta o vacío
|title=( ayuda ) - ↑ a b Aniszewski T (2007). Alcaloides: secretos de la vida, 1ª ed . Elsevier. págs. 98 –101.
- ^ Guiño M, Hartmann T (1984). Enzimología de la biosíntesis de alcaloides de quinolizidina; Química de productos naturales: Zalewski y Skolik (Eds.) . págs. 511–520.
- ^ Wink M (diciembre de 1987). "Alcaloides de quinolizidina: bioquímica, metabolismo y función en plantas y cultivos de suspensión celular" . Planta Medica . 53 (6): 509-14. doi : 10.1055 / s-2006-962797 . PMID 17269092 .
- ^ Wink M, Hartmann T (mayo de 1979). "Cadaverina - transaminación de piruvato: el paso principal de la biosíntesis enzimática de alcaloides de quinolizidina en cultivos de suspensión de células de Lupinus polyphyllus" . Cartas FEBS . 101 (2): 343–6. doi : 10.1016 / 0014-5793 (79) 81040-6 . PMID 446758 .
- ↑ a b Perrey R, Wink M (1988). "Sobre el papel de Δ1-piperideína y tripiperideína en la biosíntesis de alcaloides de quinolizidina". Z. Naturforsch . 43 (5–6): 363–369. doi : 10.1515 / znc-1988-5-607 .
- ↑ a b Atta-ur-Rahman (Ed.) (1995). Química de Productos Naturales . 15 . Elsevier. pags. 537. ISBN 978-0-444-42691-8 . CS1 maint: texto adicional: lista de autores ( enlace )
- ^ a b Roberts M, Wink M, eds. (1998). Alcaloides: bioquímica, ecología y aplicaciones medicinales . Plenum Press. págs. 112-114.
- ^ Guiño M, Hartmann T (1980). "Síntesis enzimática de alcaloides de quinolizidina en cloroplastos de lupino". Z. Naturforsch . 35 (1–2): 93–97. doi : 10.1515 / znc-1980-1-218 .
enlaces externos
-
 Medios relacionados con Sparteine en Wikimedia Commons
Medios relacionados con Sparteine en Wikimedia Commons