Sesquicarbonato de sodio - Sodium sesquicarbonate
|
|
| Identificadores | |
|---|---|
|
Modelo 3D ( JSmol )
|
|
| Tarjeta de información ECHA |
100.007.802 |
| Número CE | |
|
PubChem CID
|
|
| UNII | |
|
Tablero CompTox ( EPA )
|
|
|
|
|
|
| Propiedades | |
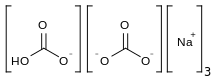
| Na 3 H (CO 3 ) 2 · 2H 2 O | |
| Apariencia | blanco, en forma de aguja |
| Densidad | 2.112 g / cm 3 (dihidrato) |
|
dihidrato 13 g / 100 mL (0 ° C) 42 g / 100 mL (100 ° C) |
|
|
Índice de refracción ( n D )
|
1.5073 (dihidrato) |
| Estructura | |
| monoclínico (dihidrato) | |
|
Salvo que se indique lo contrario, los datos se proporcionan para materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa). |
|
| Referencias de Infobox | |
Sesquicarbonato de sodio ( nombre sistemático : hidrogendicarbonato trisódico) Na 3 H (CO 3 ) 2 es una sal doble de bicarbonato de sodio y carbonato de sodio (NaHCO 3 · Na 2 CO 3 ), y tiene una estructura cristalina en forma de aguja . Sin embargo, el término también se aplica a una mezcla equimolar de esas dos sales, con cualquier agua de hidratación que incluya el carbonato de sodio, suministrada en forma de polvo.
El dihidrato , Na 3 H (CO 3 ) 2 · 2H 2 O, se encuentra en la naturaleza como el mineral evaporítico trona .
Debido a las preocupaciones sobre la toxicidad del bórax, que se retiró como producto de limpieza y lavandería, el sesquicarbonato de sodio se vende en la Unión Europea (UE) como "sustituto del bórax". También se conoce como uno de los aditivos alimentarios del número E E500 .
Usos
El sesquicarbonato de sodio se utiliza en sales de baño , piscinas, como fuente de alcalinidad para el tratamiento del agua y como un producto libre de fosfato que reemplaza al fosfato trisódico para la limpieza intensiva.
El sesquicarbonato de sodio se usa en la conservación de cobre y artefactos de aleaciones de cobre que se corroen debido al contacto con la sal (llamada " enfermedad del bronce " debido a su efecto sobre el bronce ). El cloruro de la sal forma cloruro de cobre (I) . En presencia de oxígeno y agua, incluso la pequeña cantidad de humedad en la atmósfera, el cloruro cuproso forma cloruro de cobre (II) y ácido clorhídrico , el último de los cuales disuelve el metal y forma más cloruro cuproso en una reacción autosostenida que conduce a la destrucción total del objeto. El tratamiento con sesquicarbonato de sodio elimina los cloruros de cobre (II) de la capa corroída.
También se utiliza como ablandador de agua de precipitación , que se combina con minerales de agua dura ( minerales a base de calcio y magnesio ) para formar un precipitado insoluble, eliminando estos minerales de dureza del agua. Es el resto de carbonato el que forma el precipitado, estando incluido el bicarbonato para moderar la alcalinidad del material .
Referencias
