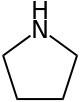
Pirrolidina - Pyrrolidine
|
|
|||
| Nombres | |||
|---|---|---|---|
|
Nombre IUPAC preferido
Pirrolidina |
|||
| Otros nombres
Azolidina
Azaciclopentano Tetrahidropirrol Prolamina Azolano |
|||
| Identificadores | |||
|
Modelo 3D ( JSmol )
|
|||
| 102395 | |||
| CHEBI | |||
| CHEMBL | |||
| ChemSpider | |||
| Tarjeta de información ECHA |
100.004.227 |
||
| Número CE | |||
| 1704 | |||
|
PubChem CID
|
|||
| Número RTECS | |||
| UNII | |||
| un numero | 1922 | ||
|
Tablero CompTox ( EPA )
|
|||
|
|||
|
|||
| Propiedades | |||
| C 4 H 9 N | |||
| Masa molar | 71,123 g · mol −1 | ||
| Apariencia | Líquido incoloro transparente | ||
| Densidad | 0,866 g / cm 3 | ||
| Punto de fusion | −63 ° C (−81 ° F; 210 K) | ||
| Punto de ebullición | 87 ° C (189 ° F; 360 K) | ||
| Miscible | |||
| Acidez (p K a ) | 11.27 (p K a de ácido conjugado en agua), 19.56 (p K a del ácido conjugado en acetonitrilo) |
||
| -54,8 · 10 −6 cm 3 / mol | |||
|
Índice de refracción ( n D )
|
1.4402 a 28 ° C | ||
| Peligros | |||
| Principales peligros | muy inflamable, nocivo, corrosivo, posible mutágeno | ||
| Ficha de datos de seguridad | MSDS | ||
| Pictogramas GHS |
  
|
||
| Palabra de señal GHS | Peligro | ||
| H225 , H302 , H314 , H318 , H332 | |||
| P210 , P233 , P240 , P241 , P242 , P243 , P260 , P261 , P264 , P270 , P271 , P280 , P301 + 312 , P301 + 330 + 331 , P303 + 361 + 353 , P304 + 312 , P304 + 340 , P305 + 351 + 338 , P310 , P312 , P321 , P330 , P363 , P370 + 378 , P403 + 235 | |||
| NFPA 704 (diamante de fuego) | |||
| punto de inflamabilidad | 3 ° C (37 ° F; 276 K) | ||
| 345 ° C (653 ° F; 618 K) | |||
| Compuestos relacionados | |||
|
Compuestos heterocíclicos de nitrógeno relacionados
|
Pirrol (aromático con dos dobles enlaces) Pirrol (un doble enlace) Pirrolizidina (dos anillos pentagonales) |
||
|
Salvo que se indique lo contrario, los datos se proporcionan para materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa). |
|||
|
|
|||
| Referencias de Infobox | |||
La pirrolidina , también conocida como tetrahidropirrol , es un compuesto orgánico con la fórmula molecular (CH 2 ) 4 NH. Es una amina secundaria cíclica , también clasificada como heterociclo saturado . Es un líquido incoloro que es miscible con agua y la mayoría de disolventes orgánicos. Tiene un olor característico que se ha descrito como "amoniacal, a pescado, a mariscos". Además de la pirrolidina misma, se conocen muchas pirrolidinas sustituidas.
Producción y síntesis
Producción industrial
La pirrolidina se prepara industrialmente mediante la reacción de 1,4-butanodiol y amoníaco a una temperatura de 165-200 ° C y una presión de 17-21 MPa en presencia de un catalizador de cobalto y óxido de níquel , que se apoya en alúmina .
La reacción se lleva a cabo en fase líquida en un reactor continuo de tubo o haz de tubos, que se opera en el método de ciclo de gas. El catalizador se dispone como un lecho fijo y la conversión se lleva a cabo en el modo de flujo descendente. El producto se obtiene después de una purificación multietapa y separación por destilación extractiva y azeotrópica .
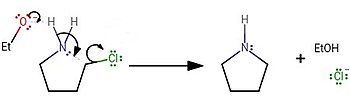
Síntesis de laboratorio
En el laboratorio, la pirrolidina generalmente se sintetizaba tratando 4-clorobutan-1-amina con una base fuerte:
Ocurrencia
Muchas modificaciones de la pirrolidina se encuentran en la química natural y sintética. La estructura del anillo de pirrolidina está presente en numerosos alcaloides naturales como la nicotina y la higrina . Se encuentra en muchos medicamentos como la prociclidina y el bepridil . También forma la base de los compuestos racetam ( por ejemplo , piracetam , aniracetam ). Los aminoácidos prolina e hidroxiprolina son, en un sentido estructural, derivados de la pirrolidina.
Reacciones
La pirrolidina es una base. Su basicidad es típica de otras dialquil aminas. En relación con muchas aminas secundarias, la pirrolidina se distingue por su compacidad, consecuencia de su estructura cíclica.
La pirrolidina se utiliza como componente básico en la síntesis de compuestos orgánicos más complejos. Se utiliza para activar cetonas y aldehídos hacia la adición nucleofílica mediante la formación de enaminas (p. Ej., Utilizado en la alquilación de enaminas de Stork ):
Referencias
- ^ Unión Internacional de Química Pura y Aplicada (2014). Nomenclatura de la química orgánica: Recomendaciones y nombres preferidos de la IUPAC 2013 . La Real Sociedad de Química . pag. 142. doi : 10.1039 / 9781849733069 . ISBN 978-0-85404-182-4.
- ^ Hall, HK (1957). "Correlación de las fuerzas base de las aminas". Revista de la Sociedad Química Estadounidense . 79 (20): 5441–5444. doi : 10.1021 / ja01577a030 .
- ↑ Kaljurand, I .; Kütt, A .; Sooväli, L .; Rodima, T .; Mäemets, V .; Leito, I .; Koppel, IA (2005). "Extensión de la escala de basicidad espectrofotométrica autoconsistente en acetonitrilo a un rango completo de 28 unidades pKa: unificación de diferentes escalas de basicidad". La Revista de Química Orgánica . 70 (3): 1019–1028. doi : 10.1021 / jo048252w . PMID 15675863 .
- ^ Pirrolidina Archivado 11/21/2017 en la Wayback Machine , The Good Company Aromas
- ↑ a b Bou Chedid, Roland; Melder, Johann-Peter; Dostalek, romano; Pastre, Jörg; Tan, Aik Meam. "Proceso de preparación de pirrolidina" . Patentes de Google . BASF SE. Archivado desde el original el 5 de julio de 2019 . Consultado el 5 de julio de 2019 .
- ^ HK Hall, Jr. (1957). "Correlación de las fuerzas base de las aminas". Mermelada. Chem. Soc . 79 (20): 5441. doi : 10.1021 / ja01577a030 .
- ^ RB Woodward , IJ Pachter y ML Scheinbaum (1974). "2,2- (trimetilenditio) ciclohexanona" . Síntesis orgánicas . 54 : 39.CS1 maint: varios nombres: lista de autores ( enlace ); Volumen colectivo , 6 , p. 1014
enlaces externos
-
 Medios relacionados con la pirrolidina en Wikimedia Commons
Medios relacionados con la pirrolidina en Wikimedia Commons