Picrotoxina - Picrotoxin
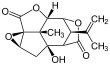
Picrotoxinina (izquierda) y picrotina (derecha)
| |||
| Datos clinicos | |||
|---|---|---|---|
| Código ATC | |||
| Identificadores | |||
| Número CAS | |||
| PubChem CID | |||
| IUPHAR / BPS | |||
| DrugBank | |||
| ChemSpider | |||
| UNII | |||
| KEGG | |||
| CHEBI | |||
| CHEMBL | |||
| Tablero CompTox ( EPA ) | |||
| Tarjeta de información ECHA |
100.004.288 |
||
| Datos químicos y físicos | |||
| Modelo 3D ( JSmol ) | |||
| |||
| |||
|
| |||
La picrotoxina , también conocida como cocculina , es un compuesto vegetal cristalino venenoso. Fue aislado por primera vez por el farmacéutico y químico francés Pierre François Guillaume Boullay (1777-1869) en 1812. El nombre "picrotoxina" es una combinación de las palabras griegas "picros" (amargo) y "toxicon" (veneno). Una mezcla de dos compuestos diferentes, la picrotoxina se encuentra naturalmente en el fruto de la planta Anamirta cocculus , aunque también se puede sintetizar químicamente.
Debido a sus interacciones con el neurotransmisor inhibidor GABA, la picrotoxina actúa como estimulante y convulsivo. Afecta principalmente al sistema nervioso central, provocando convulsiones y parálisis respiratoria en dosis suficientemente altas.
Estructura química y síntesis
La picrotoxina es una mezcla equi molar de dos compuestos, picrotoxinina (C 15 H 16 O 6 ; CAS # 17617-45-7) y picrotina (C 15 H 18 O 7 ; CAS # 21416-53-5). De los dos compuestos, la picrotina es menos activa.
La picrotoxina se encuentra naturalmente en el fruto de Anamirta cocculus , una planta trepadora de la India y otras partes del sudeste asiático. La planta es conocida por sus grandes tallos de madera blanca y flores de dulce aroma. Produce pequeños frutos de hueso, Cocculus indicus , que normalmente se secan.
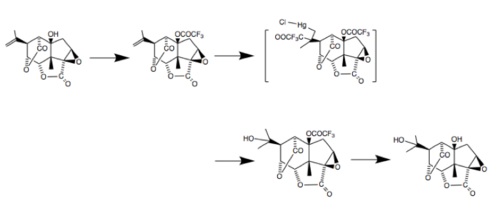
Actualmente, hay hasta cinco síntesis totales de picrotoxinina, una de las cuales fue publicada en junio de 2020 por el laboratorio Shenvi en Scripps. Esta síntesis, como la mayoría de esta molécula, implicó el uso de carvona como plantilla estereoquímica. La estrategia empleó la formación rápida del núcleo policíclico, seguida de la manipulación de los estados de oxidación de los átomos de carbono clave para producir la molécula objetivo. Algunas investigaciones sugieren que se puede producir mediante la ciclofuncionalización de los sistemas cicloalquenilo. En condiciones cinéticamente controladas, este proceso generalmente da como resultado exociclación y forma sistemas de anillos puenteados como los que se encuentran en la picrotoxina. Además, se han propuesto varias síntesis de picrotoxinina y picrotina, las dos moléculas que componen la picrotoxina. En 1980, se descubrió un proceso para convertir picrotoxinina en picrotina. Esta síntesis comienza tratando la picrotoxina con anhídrido trifluoroacético en piridina para separar los componentes.
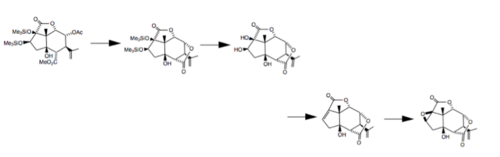
En 1988, investigadores de la Universidad de Tohoku en Japón completaron una síntesis estereoselectiva total de (-) - picrotoxinina y (-) - picrotina comenzando con (+) - 5β-hidroxi carvona . En esta síntesis, se prepararon estereoselectivamente ocho centros asimétricos en un sistema de anillo de hidrindano fusionado en cis utilizando varias reacciones diferentes: una transposición de Claisen para introducir el centro cuaternario, una reducción de una epoxi cetona mediada por organoselenio y una construcción estereoespecífica de un éster glicídico. . Los últimos pasos de este proceso se muestran a continuación.
La picrotoxina también se ha utilizado como material de partida en varios procesos sintéticos, incluida la creación de dl- picrotoxadieno, que conserva ciertas características del esqueleto de la picrotoxina.
Mecanismo de acción
Algunas fibras musculares de los crustáceos tienen inervación excitadora e inhibidora. La picrotoxina bloquea la inhibición. Se han propuesto dos teorías diferentes pero relacionadas sobre el mecanismo por el cual la picrotoxina actúa sobre las sinapsis . Una teoría es que actúa como un bloqueador de canales no competitivo para los canales de cloruro del receptor GABA A , específicamente el ionóforo de cloruro activado por ácido gamma-aminobutírico. Un estudio de 2006 encontró que, aunque no es estructuralmente similar al GABA, la picrotoxina previene el flujo de iones a través de los canales de cloruro activados por GABA. Es probable que actúe dentro de los propios canales iónicos, en lugar de en los sitios de reconocimiento de GABA. Debido a que inhibe los canales activados por GABA, los fármacos potenciadores de GABA como los barbitúricos y las benzodiazepinas pueden usarse como antídoto.
Otra investigación sugiere que la toxina actúa en cambio como un antagonista o inhibidor no competitivo de los receptores GABA. Un estudio de Newland y Cull-Candy encontró que, en concentraciones suficientemente altas, la picrotoxina reducía la amplitud de las corrientes de GABA. Sus datos indicaron que era poco probable que la picrotoxina actuara simplemente como un bloqueador de canales activado por voltaje, aunque redujo la frecuencia de apertura de canales. Más bien, encontraron que la picrotoxina "se une preferentemente a una forma agonista del receptor". Esto significa que, incluso en presencia de bajas concentraciones de picrotoxina, se reduce la respuesta de las neuronas al GABA.
Toxicidad
La picrotoxina actúa como estimulante del sistema nervioso central y respiratorio. Es extremadamente tóxico para los peces y los seres humanos, así como para los roedores y otros mamíferos. Según el Registro de efectos tóxicos de sustancias químicas, el LDLo, o la dosis letal más baja informada, es de 0,357 mg / kg. Los síntomas de la intoxicación por picrotoxina incluyen tos, dificultad para respirar, dolor de cabeza, mareos, confusión, malestar gastrointestinal, náuseas o vómitos y cambios en la frecuencia cardíaca y la presión arterial. Aunque es especialmente peligroso si se ingiere, los efectos sistémicos también pueden resultar de la inhalación o absorción en el torrente sanguíneo a través de lesiones en la piel. La picrotoxina también actúa como convulsivo. En dosis mayores, se ha encontrado que induce convulsiones clónicas o arritmias cardíacas, y las dosis especialmente altas finalmente resultan fatales, típicamente debido a parálisis respiratoria.
Aplicaciones clínicas y otros usos
Debido a su toxicidad, la picrotoxina se usa ahora más comúnmente como herramienta de investigación. Sin embargo, debido a su efecto antagonista sobre los receptores GABA, se ha utilizado como estimulante del sistema nervioso central. También se utilizó anteriormente como antídoto para el envenenamiento por depresores del SNC, especialmente barbitúricos .
Aunque no se usa comúnmente, la picrotoxina es eficaz como pesticida y pediculicida . En el siglo XIX, se usó en la preparación de multum duro, que se agregaba a la cerveza para hacerla más embriagadora. Desde entonces, esta preparación ha sido prohibida.
A pesar de su potencial toxicidad para los mamíferos en dosis suficientemente grandes, la picrotoxina también se usa a veces como potenciador del rendimiento en caballos. Está clasificada como una "sustancia de Clase I" ilegal por la Asociación Estadounidense de Caballos Cuarto de Milla . Es probable que las sustancias clasificadas como “Clase I” afecten al rendimiento y no tengan uso terapéutico en la medicina equina. En 2010, el entrenador de caballos cuarto de milla Robert Dimitt fue suspendido después de que su caballo, Stoli Signature, dio positivo por la sustancia. Al igual que con los humanos, se usa para contrarrestar el envenenamiento por barbitúricos.
Ver también
Referencias
Otras lecturas
- Ehrenberger K, Benkoe E, Felix D (1982). "Acción supresora de la picrotoxina, un antagonista de GABA, sobre el nistagmo espontáneo laberíntico y el vértigo en el hombre". Acta Oto-Laryngologica . 93 (1–6): 269–73. doi : 10.3109 / 00016488209130882 . PMID 7064710 .
- Dupont L, Dideberg O, Lamotte-Brasseur J, Angenot L (1976). "Estructura cristalina y molécula de la picrotoxina, C 15 H 16 O 6 · C 15 H 18 O 7 " . Acta Crystallographica B (en francés). 32 (11): 2987–2993. doi : 10.1107 / S0567740876009424 .
- Olsen RW, DeLorey TM (1999). "Fisiología y farmacología del receptor GABA" . En Siegel GJ, Agranoff BW, Albers RW, et al. (eds.). Neuroquímica básica: aspectos moleculares, celulares y médicos (6ª ed.). Filadelfia, Pensilvania, EE.UU .: Lippincott-Raven.