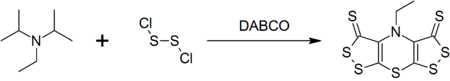N , N -Diisopropiletilamina - N,N-Diisopropylethylamine

|
|||

|
|||
|
|
|||
| Nombres | |||
|---|---|---|---|
|
Nombre IUPAC preferido
N- Etil- N - (propan-2-il) propan-2-amina |
|||
| Otros nombres | |||
| Identificadores | |||
|
Modelo 3D ( JSmol )
|
|||
| ChemSpider | |||
| Tarjeta de información ECHA |
100.027.629 |
||
| Número CE | |||
| Malla | N, N-diisopropiletilamina | ||
|
PubChem CID
|
|||
| UNII | |||
| un numero | 2733 | ||
|
Tablero CompTox ( EPA )
|
|||
|
|||
|
|||
| Propiedades | |||
| C 8 H 19 N | |||
| Masa molar | 129,247 g · mol −1 | ||
| Apariencia | Líquido incoloro | ||
| Olor | Pescado, amoniacal | ||
| Densidad | 0,742 g mL −1 | ||
| Punto de fusion | −50 a −46 ° C (−58 a −51 ° F; 223 a 227 K) | ||
| Punto de ebullición | 126,6 ° C; 259,8 ° F; 399,7 K | ||
| 4.01 g / L (a 20 ° C) | |||
| Presión de vapor | 4,1 kPa (a 37,70 ° C) | ||
|
Índice de refracción ( n D )
|
1.414 | ||
| Peligros | |||
| Pictogramas GHS |
  
|
||
| Palabra de señal GHS | Peligro | ||
| H225 , H301 , H314 , H412 | |||
| P210 , P273 , P280 , P301 + 310 , P305 + 351 + 338 , P310 | |||
| punto de inflamabilidad | 10 ° C (50 ° F; 283 K) | ||
| Límites explosivos | 0,7–6,3% | ||
| Dosis o concentración letal (LD, LC): | |||
|
LD 50 ( dosis mediana )
|
200-500 mg kg -1 (oral, rata) | ||
| Compuestos relacionados | |||
|
Aminas relacionadas
|
|||
|
Compuestos relacionados
|
|||
|
Salvo que se indique lo contrario, los datos se proporcionan para materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa). |
|||
|
|
|||
| Referencias de Infobox | |||
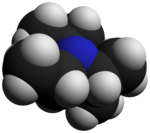
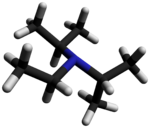
La N , N- diisopropiletilamina , o base de Hünig , es un compuesto orgánico y una amina . Lleva el nombre del químico alemán Siegfried Hünig. Se utiliza en química orgánica como base . Normalmente se abrevia como DIPEA, DIEA o i -Pr 2 NEt .
Estructura
DIPEA consta de un nitrógeno central que está unido a un grupo etilo y dos grupos isopropilo . Un solo par de electrones reside en el átomo de nitrógeno, que puede reaccionar con electrófilos. Sin embargo, como los dos grupos isopropilo y el grupo etilo ocupan gran parte del espacio que rodea al nitrógeno, solo pequeños electrófilos , como los protones, pueden reaccionar con el par único de nitrógeno.
Aparición y preparación
DIPEA está disponible comercialmente. Se prepara tradicionalmente mediante la alquilación de diisopropilamina con sulfato de dietilo .
Pure DIPEA existe como un líquido incoloro, aunque las muestras comerciales pueden ser ligeramente amarillas. Si es necesario, el compuesto se puede purificar mediante destilación a partir de hidróxido de potasio o hidruro de calcio .
Usos y reacciones
DIPEA es una base orgánica estéricamente impedida que se emplea comúnmente como eliminador de protones. Así, como la 2,2,6,6-tetrametilpiperidina y la trietilamina , DIPEA es una buena base pero un nucleófilo pobre , una combinación de propiedades que lo convierte en un reactivo orgánico útil.
Acoplamiento de amida
Se utiliza comúnmente como base impedida en reacciones de acoplamiento de amidas entre un ácido carboxílico (normalmente activado, por ejemplo, como un cloruro de ácido, como se ilustra a continuación) y una amina nucleófila. Como DIPEA está impedida y es pobremente nucleófila, no compite con la amina nucleófila en la reacción de acoplamiento.
Alquilaciones
DIPEA se ha investigado para su uso como un reactivo selectivo en la alquilación de aminas secundarias a aminas terciarias por haluros de alquilo . Esto a menudo se ve obstaculizado por una reacción de Menshutkin no deseada que forma una sal de amonio cuaternario , pero está ausente cuando DIPEA está presente.
Reacciones de acoplamiento cruzado catalizadas por metales de transición
DIPEA se puede utilizar como base en una serie de reacciones de acoplamiento cruzado catalizadas por metales de transición , como el acoplamiento de Heck y el acoplamiento de Sonogashira (como se ilustra a continuación).
Oxidación de Swern
Aunque la trietilamina se emplea tradicionalmente como base impedida en las oxidaciones de Swern , en su lugar se puede utilizar la DIPEA estructuralmente similar, como se ejemplifica a continuación.
Ejemplos de DIPEA utilizados como sustrato
DIPEA forma un compuesto heterocíclico complejo llamado escorpionina (bis ([1,2] ditiolo) - [1,4] tiazina) al reaccionar con dicloruro de disulfuro que es catalizado por DABCO en una síntesis en un solo recipiente .
Comparación con trietilamina
DIPEA y trietilamina son estructuralmente muy similares, y ambos compuestos se consideran bases orgánicas impedidas. Debido a su similitud estructural, DIPEA y trietilamina se pueden usar indistintamente en la mayoría de las aplicaciones. El átomo de nitrógeno en DIPEA está más protegido que el átomo de nitrógeno en trietilamina. Sin embargo, la trietilamina es una base ligeramente más fuerte que DIPEA; los pK a s de los respectivos ácidos conjugados en dimetilsulfóxido son 9,0 y 8,5, respectivamente.