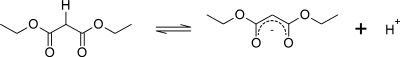Malonato de dietilo - Diethyl malonate

|
|
|
|
| Nombres | |
|---|---|
|
Nombre IUPAC
Malonato de dietilo
|
|
|
Nombre IUPAC preferido
Propanodioato de dietilo |
|
| Otros nombres
Malonato de dietilo
|
|
| Identificadores | |
|
Modelo 3D ( JSmol )
|
|
| Abreviaturas | DEM |
| 774687 | |
| CHEBI | |
| CHEMBL | |
| ChemSpider | |
| Tarjeta de información ECHA |
100.003.006 |
| Número CE | |
| Malla | Dietil + malonato |
|
PubChem CID
|
|
| Número RTECS | |
| UNII | |
|
Tablero CompTox ( EPA )
|
|
|
|
|
|
| Propiedades | |
| C 7 H 12 O 4 | |
| Masa molar | 160,17 g / mol |
| Apariencia | líquido incoloro |
| Densidad | 1,05 g / cm 3 , líquido |
| Punto de fusion | -50 ° C (-58 ° F; 223 K) |
| Punto de ebullición | 199 ° C (390 ° F; 472 K) |
| despreciable | |
| Acidez (p K a ) | 14 |
| -92,6 · 10 −6 cm 3 / mol | |
| Peligros | |
| Principales peligros | Nocivo (X), Inflamable (F) |
| Ficha de datos de seguridad | MSDS de la Universidad de Oxford |
| punto de inflamabilidad | 200 ° C (392 ° F; 473 K) |
| Compuestos relacionados | |
|
Compuestos relacionados
|
Malonato de dimetilo Ácido malónico |
|
Salvo que se indique lo contrario, los datos se proporcionan para materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa). |
|
|
|
|
| Referencias de Infobox | |
El malonato de dietilo , también conocido como DEM , es el éster dietílico del ácido malónico . Se produce naturalmente en las uvas y fresas como un incoloro líquido con una manzana -como olor , y se utiliza en perfumes . También se utiliza para sintetizar otros compuestos como barbitúricos , aromas artificiales , vitamina B 1 y vitamina B 6 .
Estructura y propiedades
El ácido malónico es un ácido dicarboxílico bastante simple , con dos grupos carboxilo muy juntos. En la formación de malonato de dietilo a partir de ácido malónico, el grupo hidroxilo (-OH) de ambos grupos carboxilo se reemplaza por un grupo etoxi (-OEt; -OCH 2 CH 3 ). El grupo metileno (-CH 2 -) en el medio de la parte malónica de la molécula de malonato de dietilo está cercado por dos grupos carbonilo (-C (= O) -).
Los átomos de hidrógeno en el carbono adyacente al grupo carbonilo en una molécula son significativamente más ácidos que los átomos de hidrógeno en un carbono adyacente a los grupos alquilo (hasta 30 órdenes de magnitud). (Esto se conoce como la posición α con respecto al carbonilo.) Los átomos de hidrógeno en un carbono adyacente a dos grupos carbonilo son incluso más ácidos porque los grupos carbonilo ayudan a estabilizar el carbanión resultante de la eliminación de un protón del grupo metileno entre ellos.
El grado de estabilización por resonancia de la base conjugada de este compuesto se representa mediante las tres formas de resonancia a continuación:
Preparación
El malonato de dietilo se puede preparar haciendo reaccionar la sal sódica del ácido cloroacético con cianuro sódico , seguido de hidrólisis básica del nitrilo resultante para dar la sal sódica del ácido malónico. La esterificación de Fischer da malonato de dietilo:
Reacciones
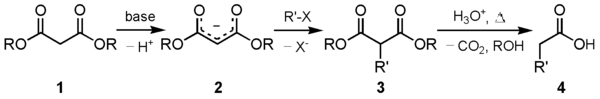
Síntesis de ésteres malónicos
Uno de los principales usos de este compuesto es en la síntesis de ésteres malónicos . El carbanión ( 2 ) formado por reacción de malonato de dietilo ( 1 ) con una base adecuada puede alquilarse con un electrófilo adecuado . Este compuesto de 1,3-dicarbonilo alquilado ( 3 ) se descarboxila fácilmente con pérdida de dióxido de carbono, para dar un ácido acético sustituido ( 4 ):
En general, se prefieren como base las sales del anión alcóxido cuya parte alquilo corresponde a la utilizada en la alquilación anterior. El uso de una base convencional puede dar lugar a productos de hidrólisis de base , por ejemplo, el hidróxido de sodio simplemente produciría malonato de sodio y el alcohol, mientras que otras sales de alcóxido causarán revuelto por transesterificación . Sólo el "mismo" anión alcóxido que el que se usó para alquilar el sitio metilénico activo desprotonado evitará tanto la hidrólisis de la base como la transesterificación.
Otras reacciones
Como muchos otros ésteres, este compuesto sufre las condensaciones de ésteres de Claisen . La ventaja de utilizar este compuesto es que se evitan reacciones de autocondensación no deseadas. Como otros ésteres, este compuesto experimenta bromación en la posición alfa.
El malonato de dietilo se puede nitrosar con nitrito de sodio en exceso en ácido acético para producir oximinomalonato de dietilo, cuya hidrogenólisis catalítica en etanol sobre Pd / C produce aminomalonato de dietilo (DEAM). El DEAM puede acetilarse para producir acetamidomalonato de dietilo (útil en la síntesis de aminoácidos), o puede añadirse con 2,4-dicetonas sustituidas en 3 a ácido acético en ebullición para obtener un rendimiento máximo de pirrol-2-carboxilatos de etilo sustituidos de diversas formas de interés para síntesis de porfirinas. (Ref. JB Paine III, D. Dolphin, J. Org. Chem. 1985, 50, 5598-5604.)