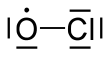Monóxido de cloro - Chlorine monoxide
|
|
|||
| Nombres | |||
|---|---|---|---|
|
Nombre IUPAC preferido
Monóxido de cloro |
|||
|
Nombre IUPAC sistemático
Clorooxidanilo |
|||
| Otros nombres
Óxido de cloro (II)
|
|||
| Identificadores | |||
|
Modelo 3D ( JSmol )
|
|||
| Abreviaturas | ClO (.) | ||
| CHEBI | |||
| ChemSpider | |||
| Malla | Clorosilo | ||
|
PubChem CID
|
|||
| UNII | |||
|
Tablero CompTox ( EPA )
|
|||
|
|||
|
|||
| Propiedades | |||
| Cl O | |||
| Masa molar | 51,45 g · mol −1 | ||
| Termoquímica | |||
| 101,8 kJ / mol | |||
|
Salvo que se indique lo contrario, los datos se proporcionan para materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa). |
|||
| Referencias de Infobox | |||
El monóxido de cloro es un radical químico con la fórmula química . Desempeña un papel importante en el proceso de agotamiento del ozono . En la estratosfera , los átomos de cloro reaccionan con las moléculas de ozono para formar monóxido de cloro y oxígeno .
Esta reacción provoca el agotamiento de la capa de ozono. Este resultado, los radicales pueden reaccionar además como tales:
regenerando el radical cloro. De esta manera, la reacción general para la descomposición del ozono es catalizada por el cloro, ya que finalmente el cloro permanece sin cambios. La reacción general es:
Este ha sido un impacto significativo del uso de CFC en la estratosfera superior; sin embargo, muchos países han acordado prohibir el uso de CFC. La naturaleza no reactiva de los CFC les permite pasar a la estratosfera, donde experimentan una foto-disociación para formar radicales Cl. Estos luego forman fácilmente monóxido de cloro, y este ciclo puede continuar hasta que dos radicales reaccionen para formar monóxido de dicloro , terminando la reacción del radical. Debido a que la concentración de CFC en la atmósfera es muy baja, la probabilidad de que una reacción termine es extremadamente baja, lo que significa que cada radical puede descomponer muchos miles de moléculas de ozono.
Aunque el uso de CFC fue prohibido en muchos países, los CFC pueden permanecer en la atmósfera durante unos 50-500 años. Esto hace que se produzcan muchos radicales de cloro y, por lo tanto, se descomponga una cantidad significativa de moléculas de ozono antes de que los radicales de cloro puedan reaccionar con el monóxido de cloro para formar monóxido de dicloro .
Referencias
| Este artículo relacionado con un compuesto inorgánico es un trozo . Puedes ayudar a Wikipedia expandiéndolo . |