Geometría molecular doblada - Bent molecular geometry
| Geometría molecular doblada | |
|---|---|
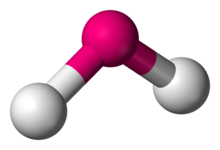 | |
| Ejemplos de | H 2 O , SO 2 |
| Grupo de puntos | C 2v |
| Número de coordinación | 2 |
| Ángulo (s) de enlace | 90 ° <θ <120 ° |
| μ (polaridad) | > 0 |

En química , las moléculas con una disposición no colineal de dos enlaces adyacentes tienen geometría molecular angular , también conocido como angular o en forma de V . Ciertos átomos, como el oxígeno, casi siempre establecerán sus dos (o más) enlaces covalentes en direcciones no colineales debido a su configuración electrónica . El agua (H 2 O) es un ejemplo de una molécula doblada, así como sus análogos . El ángulo de enlace entre los dos átomos de hidrógeno es de aproximadamente 104,45 °. La geometría no lineal se observa comúnmente para otras moléculas e iones triatómicos que contienen solo elementos del grupo principal, siendo ejemplos destacados el dióxido de nitrógeno (NO 2 ), el dicloruro de azufre (SCl 2 ) y el metileno (CH 2 ).
Esta geometría es casi siempre consistente con la teoría VSEPR , que generalmente explica la no colinealidad de átomos con presencia de pares solitarios . Hay varias variantes de flexión, donde la más común es AX 2 E 2 donde dos enlaces covalentes y dos pares solitarios del átomo central (A) forman una capa completa de 8 electrones . Tienen ángulos centrales de 104 ° a 109,5 °, donde este último es consistente con una teoría simplista que predice la simetría tetraédrica de cuatro orbitales sp 3 hibridados. Los ángulos reales más comunes son 105 °, 107 ° y 109 °: varían debido a las diferentes propiedades de los átomos periféricos (X).
Otros casos también experimentan hibridación orbital , pero en diferentes grados. Las moléculas AX 2 E 1 , como SnCl 2 , tienen solo un par solitario y el ángulo central alrededor de 120 ° (el centro y dos vértices de un triángulo equilátero ). Tienen tres orbitales sp 2 . También existen compuestos AX 2 con hibridación sd de metales de transición sin pares solitarios: tienen el ángulo central de aproximadamente 90 ° y también se clasifican como doblados.
