Aminoácido aromático - Aromatic amino acid
Un aminoácido aromático ( AAA ) es un aminoácido que incluye un anillo aromático . Entre los 20 aminoácidos estándar, los siguientes son aromáticos: fenilalanina , triptófano y tirosina . Sin embargo, además de ser aromática, la tirosina se puede clasificar como un aminoácido polar. Además, aunque la histidina contiene un anillo aromático, sus propiedades básicas hacen que se clasifique predominantemente como un aminoácido polar; sin embargo, el compuesto sigue siendo aromático.
Estructura y propiedades químicas
Los aminoácidos aromáticos absorben la luz ultravioleta a una longitud de onda superior a 250 nm y producen fluorescencia . Esta característica se utiliza en análisis cuantitativos, especialmente para determinar las concentraciones de estos aminoácidos en solución. Esto se logró mediante la utilización de un espectrofotómero UV y la ecuación de la ley de Beer-Lambert . La mayoría de las proteínas tendrán un máximo de absorción a 280 nm debido a la presencia de aminoácidos aromáticos en su estructura primaria. Sin embargo, debido a que existen varios aminoácidos aromáticos, este método tiene poca precisión; Para mitigar este problema, la proteína deseada debe ser pura y se conoce su absortividad molar . Además, una proteína sin aminoácidos aromáticos no tendrá un máximo de absorción a aproximadamente 280 nm. La presencia de ácidos nucleicos en la proteína puede disminuir aún más la precisión del método debido a la presencia de anillos de purina y pirimidina , que tienen un máximo de absorción a aproximadamente 260 nm. La fenilalanina tiene una absorbancia relativamente débil en comparación con los otros aminoácidos aromáticos estándar; su presencia en una proteína solo puede detectarse si no hay triptófano y tirosina. Su máxima absorción ocurre a 257 nm. En consecuencia, tiene una fluorescencia relativamente débil. El triptófano tiene la absorbancia relativa más alta en comparación con los otros aminoácidos aromáticos estándar; su absorción máxima ocurre a 280 nm. La cadena lateral del triptófano no titula. El máximo de absorción de tirosina se produce a 274 nm. En reacciones químicas, la tirosina puede funcionar como nucleófilo. Los aminoácidos aromáticos también juegan un papel crucial en las interacciones glucano-proteína .
Ocurrencia y funciones en bioquímica
Vías de biosíntesis
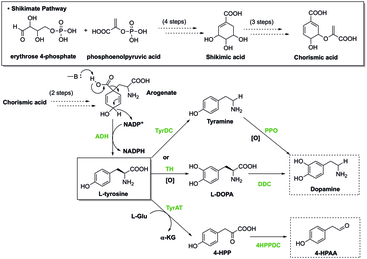
Camino Shikimate
En las plantas, la vía del shikimato conduce primero a la formación de corismato , que es el precursor de la fenilalanina, la tirosina y el triptófano. Estos aminoácidos aromáticos son derivados de muchos metabolitos secundarios , todos esenciales para las funciones biológicas de una planta, como las hormonas salicilato y auxina . Esta vía contiene enzimas que pueden ser reguladas por inhibidores, que pueden detener la producción de corismato y, en última instancia, las funciones biológicas del organismo. Los herbicidas y antibióticos actúan inhibiendo estas enzimas involucradas en la biosíntesis de aminoácidos aromáticos, volviéndolos tóxicos para las plantas. El glifosato , un tipo de herbicida, se usa para controlar la acumulación de hojas verdes en exceso. Además de destruir las verduras, el glifosato puede afectar fácilmente el mantenimiento de la microbiota intestinal en los organismos hospedadores al inhibir específicamente la 5-enolpiruvilshikinato-3-fosfato sintasa que previene la biosíntesis de aminoácidos aromáticos esenciales. La inhibición de esta enzima da como resultado trastornos como enfermedades gastrointestinales y enfermedades metabólicas.
Aminoácidos aromáticos como precursores
Los aminoácidos aromáticos a menudo sirven como precursores de otras moléculas. Por ejemplo, en la producción de epinefrina, la fenilalanina es la molécula de partida. La reacción se indica a continuación:
Fenilalanina → Tirosina → L-DOPA → Dopamina → Norepinefrina → Epinefrina
La tirosina también es un precursor de la síntesis de octopamina y melanina en numerosos organismos. En la producción de tiroxina, la fenilalanina también sirve como precursor inicial:
Fenilalanina → Tirosina → Tiroxina
En la producción de serotonina, el triptófano es la molécula de partida, como se indica a continuación:
Triptófano → 5-hidroxitriptófano → Serotonina
Además, la histidina es la precursora de la histamina . El triptófano es la molécula de partida en la síntesis de triptamina, serotonina, auxina, quinureninas y melatonina.
Requerimientos nutricionales
Los animales obtienen aminoácidos aromáticos de su dieta, pero todas las plantas y microorganismos deben sintetizar sus aminoácidos aromáticos a través de la vía del shikimato, que es metabólicamente costosa , para producirlos. La fenilalanina , el triptófano y la histidina son aminoácidos esenciales para los animales. Dado que no se sintetizan en el cuerpo humano, deben derivarse de la dieta. La tirosina es semi-esencial; por lo tanto, puede ser sintetizado por el animal, pero solo a partir de fenilalanina. La fenilcetonuria , un trastorno genético que se produce como resultado de la incapacidad de degradar la fenilalanina, se debe a la falta de la enzima fenilalanina hidroxilasa . La falta de triptófano en la dieta puede causar retraso en el desarrollo del esqueleto. La ingesta excesiva de aminoácidos aromáticos mucho más allá de los niveles obtenidos mediante el consumo normal de proteínas puede provocar hipertensión , algo que podría pasar desapercibido durante mucho tiempo en personas sanas. También podría deberse a otros factores, como el uso de diversas hierbas y alimentos como el chocolate, que inhiben las enzimas monoaminooxidasa en diversos grados, y también algunos medicamentos. Las trazas de aminas aromáticas como la tiramina pueden desplazar la noradrenalina de las vesículas de monoaminas periféricas y, en personas que toman IMAO, esto ocurre hasta el punto de poner en peligro la vida. para el síndrome del pañal azul es una enfermedad autosómica recesiva que es causada por la mala absorción de triptófano en el cuerpo.
Ver también
- Descarboxilasa aromática de L-aminoácido
- Código genético ampliado
- Fenilcetonuria
- Tirosina hidroxilasa
- Neurotransmisor
Referencias
Otras lecturas
- Maeda H, Dudareva N (2012). "La vía del shikimato y la biosíntesis de aminoácidos aromáticos en plantas". Revisión anual de biología vegetal . 63 : 73-105. doi : 10.1146 / annurev-arplant-042811-105439 . PMID 22554242 .
- "Deficiencia de tirosina hidroxilasa" . Referencia casera de la genética . Biblioteca Nacional de Medicina de EE. UU. 2020.
enlaces externos
-
 Medios relacionados con los aminoácidos aromáticos en Wikimedia Commons
Medios relacionados con los aminoácidos aromáticos en Wikimedia Commons - Aromatic + Amino + Acids en los encabezados de temas médicos (MeSH) de la Biblioteca Nacional de Medicina de EE. UU .