Trichobilharzia regenti -Trichobilharzia regenti
| Trichobilharzia regenti | |
|---|---|

|
|
| Trichobilharzia regenti , cercaria | |
|
clasificación cientifica |
|
| Reino: | Animalia |
| Filo: | Platelmintos |
| Clase: | Rhabditophora |
| Pedido: | Diplostomida |
| Familia: | Schistosomatidae |
| Género: | Trichobilharzia |
| Especies: |
T. regenti
|
| Nombre binomial | |
|
Trichobilharzia regenti Horák, Kolářová y Dvořák, 1998
|
|
Trichobilharzia regenti es un gusano plano parasitario neuropatógenode las aves que también causa dermatitis por cercarias en humanos. La especie se describió originalmente en 1998 en la República Checa y luego se detectó también en otros países europeos, por ejemplo, Dinamarca , Alemania , Francia , Islandia , Polonia , Suiza o Rusia , e incluso en Irán . Por su comportamiento neurotrópico único en huéspedes vertebrados, las interacciones huésped-parásito se estudian ampliamente en términos de biología molecular, bioquímica e inmunología.
Ciclo vital
El ciclo de vida de T. regenti es análogo al de los esquistosomas humanos . Los trematodos adultos se aparean en una mucosa nasal de aves anátidas (por ejemplo, Anas platyrhynchos , Spatula clypeata o Cairina moschata ) y producen huevos con miracidios que eclosionan directamente en el tejido del hospedador y se filtran al exterior cuando el ave bebe o se alimenta. Una vez en el agua, los miracidios nadan usando sus cilios y buscan activamente un hospedador intermedio de moluscos adecuado ( Radix lagotis , Radix labiata , Radix peregra ). En el caracol, los miracidios se convierten en un esporocisto primario en el que se forman esporocistos secundarios y posteriormente dan lugar a cercarias.
Las cercarias , larvas infecciosas, salen del caracol y penetran en la piel de un huésped aviar. Después de la penetración en la piel del huésped, se desprende del glucocáliz superficial inmunogénico y se transforma en esquistosomula (estadio subadulto, sg. Schistosomulum). Schistosomula luego busca nervios periféricos para usarlos para llegar a la médula espinal. A través de él continúan su migración hacia el cerebro y, finalmente, el tejido nasal en un pico. Aquí maduran, copulan y ponen huevos provocando patología (infiltración inflamatoria, hemorragias).
Si los mamíferos están infectados por cercarias (en lugar de aves), los parásitos mueren en la piel y quedan atrapados por la respuesta inmune. La manifestación clínica de dicha infección se conoce como una enfermedad alérgica desatendida llamada dermatitis por cercaria (o picazón del nadador ). En ratones, especialmente en inmunodeficientes, se observó migración del parásito a la médula espinal.
Se puede mantener un ciclo de vida completo de T. regenti en condiciones de laboratorio utilizando Radix lagotis y el pato doméstico ( Anas platyrhynchos f. Domestica) como huéspedes intermedios y definitivos, respectivamente. Curiosamente, los patos domésticos también pueden servir como reservorios en sitios de acuicultura, como campos de arroz. Para estudiar la biología de T. regenti en mamíferos, se utilizan cepas de ratón C57BL / 6 , BALB / c a SCID como huéspedes accidentales.
Migración en hospedadores vertebrados
Cuando las cercarias de T. regenti encuentran un hospedador aviar o mamífero, penetran en su piel. Para ello, están equipados con cisteína peptidasas presentes en sus productos excretores / secretores, que son capaces de degradar la queratina y el colágeno . Los experimentos con la forma recombinante preparada en laboratorio de la cisteína peptidasa catepsina B2 de T. regenti (TrCB2) confirmaron su capacidad para escindir las proteínas de la piel (colágeno, queratina y elastina).
Después de penetrar la piel, las cercarias se transforman en esquistosomula y comienzan una migración a través del cuerpo del huésped. Evitan la penetración en los capilares sanguíneos y prefieren entrar en los nervios periféricos de las extremidades del huésped. La esquistosomula se encuentra en los nervios periféricos de patos y ratones tan pronto como 1,5 y 1 día después de la infección (DPI), respectivamente. En ambos tipos de hospedadores, la esquistosomula exhibe una alta afinidad con el sistema nervioso central al que ingresan a través de las raíces espinales . Según la observación reciente mediante técnicas de imagen 3D (ultramicroscopia y micro-TC ), la esquistosómula parece migrar preferentemente a través de la sustancia blanca de la médula espinal tanto en aves como en mamíferos.
El siguiente curso de la infección difiere en huéspedes finales y accidentales. En los patos, la esquistosomula se observa en los segmentos sinsacrales de una médula espinal 3 DPI y 7-8 días después (10-11 DPI) llegan al cerebro. En su localización final (el tejido nasal), ocurren entre 13 y 14 DPI y la puesta de huevos comienza con 15 DPI. En los ratones, la primera esquistosomula se encuentra en la médula espinal lumbar ya con 2 DPI y el bulbo raquídeo se invade al día siguiente, pero solo en algunos individuos. La mayor parte de la esquistosomula permanece localizada en la médula espinal torácica y cervical y solo excepcionalmente migra al cerebro. No se ha detectado la presencia de gusanos en una cavidad nasal ni se ha notado su maduración en el tejido nervioso. El desarrollo de la esquistosómula en ratones se inhibe probablemente debido a la respuesta inmune del huésped y / o la presencia / ausencia de algunos factores esenciales (nutricionales, estimulantes) del huésped.
Patología en hospedadores vertebrados
En los huéspedes vertebrados infectados por T. regenti , los estados patológicos pueden deberse a:
- cercarias penetrantes que se transforman en esquistosomula en la piel ,
- esquistosomula que migra a través del sistema nervioso central (SNC) ,
- adultos que ponen huevos en la mucosa nasal (solo en huéspedes aviares).
Aunque los ratones son huéspedes accidentales, la mayoría de los estudios relacionados con los efectos patológicos de T. regenti se realizaron en este modelo.
Patología de la piel
En la fase inicial de la infección, la esquistosómula transformada temprana se localiza en la piel . Aún no se ha completado la información sobre patología en la piel de las aves. En ratones, el edema inmediato y el engrosamiento del sitio aparecen tan pronto como 30 minutos después de la penetración de las cercarias; el eritema también es evidente. En 48 horas, se desarrollan focos inflamatorios que contienen neutrófilos, eosinófilos, macrófagos, linfocitos CD4 + y mastocitos desgranulantes alrededor de los parásitos.
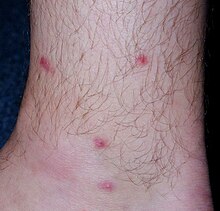
En caso de infecciones repetidas, la infiltración celular es sustancialmente elevada y la inflamación extensa puede conducir a la formación de grandes abscesos o incluso a necrosis epidérmica y / o dérmica. En los seres humanos, los síntomas clínicos de la penetración de las cercarias consisten en la formación de máculas / pápulas en los sitios por donde el parásito entró en la piel acompañada de picazón intensa. La manifestación es más grave en personas previamente sensibilizadas. Esta enfermedad, causada no solo por T. regenti sino también por cercarias de otras especies de esquistosomas de aves, se denomina dermatitis por cercarias (también conocida como picazón del nadador ). Se considera una enfermedad alérgica desatendida.
Patología del SNC
La siguiente fase de la infección por T. regenti está representada por la migración de la esquistosomula en el sistema nervioso central . Esto se acompaña de graves disfunciones neurológicas en aves que sufren parálisis de las patas y trastornos del equilibrio. En patos, se observó meningitis eosinofílica con parásitos rodeados de eosinófilos y heterófilos. Además, los leucocitos infiltraron espacios perivasculares y tejidos adyacentes al canal central.
En esta etapa, la esquistosomula se alimenta de tejido nervioso, como lo demuestra la detección de oligodendrocitos y neuronas en la luz del intestino del parásito. Una cisteína peptidasa catepsina B1 de T. regenti (TrCB1) localizada en los intestinos de la esquistosomula migratoria es capaz de degradar la proteína básica de la mielina , por lo que probablemente sirva para la digestión del tejido nervioso. No obstante, es probable que la ingestión de tejido nervioso sólo tenga un efecto patógeno menor sobre el tejido nervioso central del huésped. Esto se basa en observaciones de parálisis de las piernas solo en huéspedes inmunodeprimidos, mientras que en experimentos con cepas de ratones inmunocompetentes, los animales infectados no revelaron ningún trastorno neurológico. Los síntomas neurológicos se originan probablemente en un daño mecánico del tejido nervioso que conduce a cambios distróficos o incluso necróticos de las neuronas y daño axonal. La causa son esquistosómulas migratorias grandes (aproximadamente 340 × 80 μm) que no son destruidas por una respuesta inmune adecuada.
Patología nasal
En los hospedadores aviares, T. regenti llega al tejido nasal donde se aparean y ponen huevos . La patología macroscópica en este sitio consiste en hemorragias focales dispersas por toda la mucosa. Hay infiltrados de linfocitos alrededor de los huevos e incluso se forman granulomas que contienen linfocitos, eosinófilos y heterófilos en fases posteriores. Hay infiltrados similares alrededor de los miracidios libres, pero no se registró la formación de granulomas. No se observó reacción celular en la vecindad de gusanos adultos.
Respuesta inmune en hospedadores vertebrados
Patos
Los registros sobre la respuesta inmune celular a T. regenti en patos son bastante escasos. Sin embargo, solo se observó infiltración celular de los sitios de piel afectados en patos infectados repetidamente, sin una caracterización adicional de las células infiltrantes. En el SNC, los eosinófilos y heterófilos rodean al parásito pero no impiden su migración hacia la localización final en la mucosa nasal.
Teniendo en cuenta la respuesta de anticuerpos , la IgM anticercarial culmina 15 DPI, mientras que la IgY anticercarial alcanza un pico de 30 DPI. Los patos infectados a mayor edad tienen niveles más altos de IgY anticercarial que los infectados a menor edad. Sin embargo, los niveles de IgY anticercarial no dependen en gran medida de la dosis de infección. Varios antígenos de parásitos reconocidos específicamente por la IgY del huésped se consideran candidatos para inmunodiagnóstico.
Ratones
La infección se manifiesta como una reacción de hipersensibilidad de tipo I temprana y una inflamación cutánea de fase tardía.
La respuesta inmune celular está representada por la producción de citocinas proinflamatorias ( IL-1β , IL-6 e IL-12p40 ) y antiinflamatorias ( IL-10 ) en una piel de ratones infectados por primera vez. Los linfocitos de la piel que drenan los ganglios linfáticos exhiben polarización mixta Th1 / Th2 después de la exposición a antígenos del parásito. Por el contrario, los antiinflamatorios IL-4 e IL-10 dominan en ratones infectados repetidamente que también secretan grandes cantidades de histamina de los mastocitos . Los linfocitos de la piel que drenan los ganglios linfáticos producen IL-4 e IL-5 después de la estimulación con antígenos del parásito, lo que muestra la polarización Th2 de la respuesta inmune del huésped.
En una médula espinal, se desarrolla una fuerte respuesta inmunitaria celular que consiste en granulocitos , células plasmáticas , macrófagos y células T en ratones inmunocompetentes , especialmente alrededor de la esquistosomula dañada. Los ratones deficientes en CD3 desarrollan una inflamación leve o nula que se acompaña de síntomas neurológicos debido al daño mecánico causado al tejido nervioso. La microglía activada se localiza en las vías migratorias de la esquistosomula y en las lesiones inflamatorias que contienen residuos de parásitos. Por lo tanto, se sugiere tomar parte en la destrucción esquistosómula ya sea solo o en cooperación con los macrófagos y las células T . Los astrocitos hipertrofiados se localizan en las trayectorias migratorias y en las proximidades de la esquistosomula, lo que implica su papel en la respuesta inmune y la reparación tisular. Se demostró que los astrocitos murinos y la microglía producen citocinas proinflamatorias ( IL-6 y TNF-α ) y óxido nítrico después de la exposición in vitro a antígenos del parásito, lo que respalda su papel en la respuesta inmune del huésped.
La respuesta de anticuerpos IgM se dirige principalmente a los epítopos de carbohidratos de las moléculas del parásito. Las IgG1 e IgG2a específicas de parásitos están presentes tan pronto como 7 DPI. Se pueden detectar niveles altos de IgG1 e IgG2b , pero no de IgG2a , específicos para la mayoría de los epítopos proteicos del homogeneizado de cercaria, hasta 150 DPI, en ratones infectados repetidamente. El nivel de IgE total aumenta tan pronto como 10 DPI y permanece alto hasta 150 DPI en ratones reinfectados. El aumento de la producción de IgG1 específica de antígeno e IgE total , pero una ligera disminución de la IgG2b específica de antígeno corroboran la inmunopolarización de Th2 en individuos infectados repetidamente.
Humanos
La manifestación clínica de la respuesta inmune humana a la infección por T. regenti se conoce como dermatitis por cercarias ( también conocida como picazón del nadador ). La mayoría de los seres humanos (82% de los adultos, 57% de los niños) que han experimentado dermatitis por cercarias (causada por especies indeterminadas de esquistosoma de aves) tienen niveles elevados de IgG específica del antígeno de T. regenti , pero no de IgE . El homogeneizado cercarial y los productos excretores-secretores de T. regenti inducen a los basófilos de seres humanos sin antecedentes de dermatitis cercarial a desgranular y liberar IL-4 .