Púrpura trombocitopénica trombótica - Thrombotic thrombocytopenic purpura
| Púrpura trombocitopénica trombótica | |
|---|---|
| Otros nombres | Síndrome de Moschcowitz, púrpura trombocitopénica trombótica idiopática |
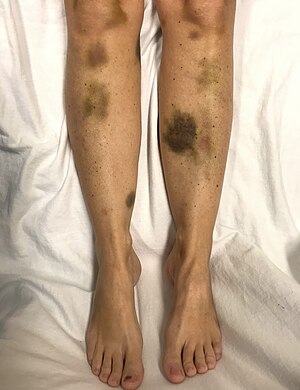 | |
| Hematomas espontáneos en una mujer con plaquetas críticamente bajas | |
| Especialidad | Hematología |
| Síntomas | Grandes hematomas , fiebre , debilidad, dificultad para respirar , confusión, dolor de cabeza |
| Inicio habitual | Edad adulta |
| Causas | Desconocido, infecciones bacterianas , ciertos medicamentos, enfermedades autoinmunes , embarazo |
| Método de diagnóstico | Basado en síntomas y análisis de sangre. |
| Diagnóstico diferencial | Síndrome urémico hemolítico (SUH), síndrome urémico hemolítico atípico (SUHa) |
| Tratamiento | Intercambio de plasma , inmunosupresores |
| Pronóstico | <20% de riesgo de muerte |
| Frecuencia | 1 de cada 100.000 personas |
La púrpura trombocitopénica trombótica ( PTT ) es un trastorno sanguíneo que provoca la formación de coágulos sanguíneos en los vasos sanguíneos pequeños de todo el cuerpo. Esto da como resultado un recuento bajo de plaquetas , glóbulos rojos bajos debido a su descomposición y, a menudo , disfunción renal , cardíaca y cerebral . Los síntomas pueden incluir grandes hematomas , fiebre , debilidad, dificultad para respirar , confusión y dolor de cabeza . Pueden ocurrir episodios repetidos.
En aproximadamente la mitad de los casos se identifica un desencadenante, mientras que en el resto se desconoce la causa. Los desencadenantes conocidos incluyen infecciones bacterianas , ciertos medicamentos, enfermedades autoinmunes como el lupus y el embarazo . El mecanismo subyacente generalmente involucra anticuerpos que inhiben la enzima ADAMTS13 . Esto da como resultado una disminución de la descomposición de grandes multímeros del factor von Willebrand (vWF) en unidades más pequeñas. Con menos frecuencia, la PTT se hereda de los padres de una persona , lo que se conoce como síndrome de Upshaw-Schulman , de modo que la disfunción de ADAMTS13 está presente desde el nacimiento. El diagnóstico generalmente se basa en síntomas y análisis de sangre. Puede apoyarse midiendo la actividad o los anticuerpos contra ADAMTS13.
Con el intercambio de plasma, el riesgo de muerte ha disminuido de más del 90% a menos del 20%. También se pueden usar inmunosupresores , como glucocorticoides y rituximab . Por lo general, no se recomiendan las transfusiones de plaquetas .
Aproximadamente 1 de cada 100.000 personas se ven afectadas. El inicio suele ser en la edad adulta y las mujeres se ven afectadas con mayor frecuencia. Aproximadamente el 10% de los casos comienzan en la niñez. La afección fue descrita por primera vez por Eli Moschcowitz en 1924. El mecanismo subyacente se determinó en las décadas de 1980 y 1990.
Signos y síntomas
Los signos y síntomas de la PTT pueden al principio ser sutiles e inespecíficos. Muchas personas experimentan una enfermedad similar a la influenza o diarreica antes de desarrollar TTP. Los síntomas neurológicos son muy comunes y varían mucho en severidad. Los síntomas que se informan con frecuencia incluyen sentirse muy cansado , confusión y dolores de cabeza . También se pueden observar convulsiones y síntomas similares a los de un accidente cerebrovascular . Otros síntomas incluyen, entre otros, ictericia o palidez de la piel, frecuencia cardíaca rápida o dificultad para respirar, o puntos morados o rojizos del tamaño de un alfiler en la piel conocidos como petequias.
A medida que avanza la TTP, se forman coágulos de sangre dentro de los vasos sanguíneos pequeños (microvasculatura) y se consumen las plaquetas (células de la coagulación). Como resultado, pueden producirse hematomas y, en raras ocasiones, sangrado. Los hematomas a menudo toman la forma de púrpura , mientras que el sitio más común de sangrado, si ocurre, es en la nariz o las encías. También pueden aparecer hematomas más grandes ( equimosis ). La presentación clásica de TTP, que ocurre en menos del 10% de las personas, incluye cinco signos médicos. Estos son:
- Fiebre
- Cambios en el estado mental
- Trombocitopenia
- Función renal reducida
- Anemia hemolítica ( anemia hemolítica microangiopática ).
En el examen se puede encontrar presión arterial alta ( hipertensión ).
Causas
La TTP, como ocurre con otras anemias hemolíticas microangiopáticas (MAHA), es causada por la agregación espontánea de plaquetas y la activación de la coagulación en los vasos sanguíneos pequeños. Las plaquetas se consumen en el proceso de agregación y se unen al vWF. Estos complejos plaquetas-vWF forman pequeños coágulos de sangre que circulan en los vasos sanguíneos y provocan el cizallamiento de los glóbulos rojos, lo que resulta en su ruptura y formación de esquistocitos . Las dos causas mejor conocidas de TTP se deben a la autoinmunidad y una deficiencia hereditaria de ADAMTS13 (conocida como síndrome de Upshaw-Schülman). La mayoría de los casos restantes son secundarios a algún otro factor.
Autoinmune
La PTT de causa desconocida se conoció durante mucho tiempo como PTT idiopática, pero en 1998 se demostró que la mayoría de los casos estaban causados por la inhibición de la enzima ADAMTS13 por anticuerpos . La relación de la reducción de ADAMTS13 con la patogénesis de la PTT se conoce como hipótesis Furlan-Tsai, en honor a los dos grupos independientes de investigadores que publicaron su investigación en el mismo número del New England Journal of Medicine . Estos casos ahora se clasifican como una enfermedad autoinmune y se conocen como TTP autoinmune (no debe confundirse con púrpura trombocitopénica inmune / idiopática ).
ADAMTS13 es una metaloproteinasa responsable de la descomposición del factor von Willebrand (vWF), una proteína que une las plaquetas, los coágulos sanguíneos y la pared de los vasos sanguíneos en el proceso de coagulación sanguínea. Los multímeros de vWF muy grandes son más propensos a producir coagulación. Por lo tanto, sin la escisión adecuada del vWF por ADAMTS13, la coagulación se produce a una velocidad más alta, especialmente en la microvasculatura, parte del sistema de vasos sanguíneos donde el vWF es más activo debido a la alta tensión de cizallamiento . En la PTT idiopática, la actividad de ADAMTS13 gravemente disminuida (<5% de lo normal) se puede detectar en la mayoría (80%) de las personas, y los inhibidores a menudo se encuentran en este subgrupo (44 a 56%).
Genético
Esta condición también puede ser congénita. Estos casos pueden deberse a mutaciones en el gen ADAMTS13. Esta forma hereditaria de TTP se llama síndrome de Upshaw-Schulman . Las personas con esta deficiencia heredada de ADAMTS13 tienen un fenotipo sorprendentemente leve, pero desarrollan TTP en situaciones clínicas con niveles elevados del factor von Willebrand, por ejemplo, una infección. Según se informa, menos del 1% de todos los casos de PTT se deben al síndrome de Upshaw-Schulman. Las personas con este síndrome generalmente tienen entre el 5 y el 10% de la actividad normal de ADAMTS-13.
Secundario
La PTT secundaria se diagnostica cuando el historial de la persona menciona una de las características conocidas asociadas con la PTT. Comprende aproximadamente el 40% de todos los casos de TTP. Los factores predisponentes son:
- Cáncer
- Trasplante de médula ósea
- El embarazo
-
Uso de medicamentos :
- Medicamentos antivirales ( aciclovir )
- Ciertos medicamentos de quimioterapia como gemcitabina y mitomicina C
- Quinina
- Oximorfona
- Quetiapina
- Bevacizumab
- Sunitinib
- Inhibidores de la agregación plaquetaria ( ticlopidina , clopidogrel y prasugrel )
- Inmunosupresores ( ciclosporina , mitomicina , tacrolimus / FK506, interferón-α )
- Fármacos que alteran las hormonas (estrógenos, anticonceptivos, terapia de reemplazo hormonal)
- Infección por VIH-1
El mecanismo de la PTT secundaria es poco conocido, ya que la actividad de ADAMTS13 generalmente no está tan deprimida como en la PTT idiopática y no se pueden detectar inhibidores. La etiología probable puede implicar, al menos en algunos casos, daño endotelial, aunque la formación de trombos que provocan la oclusión del vaso puede no ser esencial en la patogenia de la PTT secundaria. Estos factores también pueden considerarse una forma de SHUa secundario; las personas que presentan estas características son, por tanto, candidatos potenciales para la terapia anticomplemento.
Fisiopatología
El mecanismo subyacente típicamente implica la inhibición mediada por autoanticuerpos de la enzima ADAMTS13 , una metaloproteasa responsable de escindir grandes multímeros del factor von Willebrand (vWF) en unidades más pequeñas. El aumento de los multímeros circulantes de vWF aumenta la adhesión de las plaquetas a las áreas de lesión endotelial , particularmente donde se unen las arteriolas y los capilares , lo que a su vez da como resultado la formación de pequeños coágulos de plaquetas llamados trombos. A medida que las plaquetas se consumen en la formación de trombos, esto conduce a una disminución en el número total de plaquetas circulantes, lo que puede causar hemorragias potencialmente mortales. Los glóbulos rojos que pasan por los coágulos microscópicos están sujetos a un esfuerzo cortante , que daña sus membranas, lo que lleva a la ruptura de los glóbulos rojos dentro de los vasos sanguíneos, lo que a su vez conduce a la anemia y la formación de esquistocitos . La presencia de estos coágulos de sangre en los vasos sanguíneos pequeños reduce el flujo sanguíneo a los órganos, lo que resulta en lesiones celulares y daños en los órganos terminales .
Diagnóstico
Diagnóstico diferencial
La PTT se caracteriza por una microangiopatía trombótica (MAT), la formación de coágulos de sangre en pequeños vasos sanguíneos de todo el cuerpo, que pueden provocar anemia hemolítica microangiopática y trombocitopenia. Esta característica es compartida por dos síndromes relacionados, el síndrome urémico hemolítico (SUH) y el síndrome urémico hemolítico atípico (SUHa). En consecuencia, el diagnóstico diferencial de estas enfermedades que causan MAT es fundamental. Además de MAT, uno o más de los siguientes síntomas pueden estar presentes en cada una de estas enfermedades: síntomas neurológicos (por ejemplo, confusión, convulsiones cerebrales, ataques); insuficiencia renal (por ejemplo , creatinina elevada , tasa de filtración glomerular estimada disminuida [eGFR], análisis de orina anormal); y síntomas gastrointestinales (GI) (por ejemplo, diarrea, náuseas / vómitos, dolor abdominal, gastroenteritis. A diferencia del SUH y el SUHa, se sabe que la PTT es causada por un defecto adquirido en la proteína ADAMTS13, por lo que una prueba de laboratorio muestra ≤5% de los niveles normales de ADAMTS13 es indicativo de TTP. Los niveles de ADAMTS13 superiores al 5%, junto con una prueba positiva para la toxina shiga / E. coli enterohemorrágica (EHEC), son más probablemente indicativos de HUS, mientras que la ausencia de toxina shiga / EHEC puede confirmar un diagnóstico de SHIa .
Tratamiento
Debido a la alta mortalidad de la PTT no tratada, se hace un diagnóstico presuntivo de PTT incluso cuando solo se observan anemia hemolítica microangiopática y trombocitopenia y se inicia la terapia. La transfusión está contraindicada en la PTT trombótica, ya que estimula la coagulopatía. Desde principios de la década de 1990, la plasmaféresis se ha convertido en el tratamiento de elección para la PTT. Se trata de una exanguinotransfusión que implica la extracción del plasma sanguíneo de la persona a través de aféresis y el reemplazo con plasma de un donante (plasma fresco congelado o criosupernadante ); el procedimiento debe repetirse diariamente para eliminar el inhibidor y mitigar los síntomas. Si no se dispone de aféresis, se puede infundir plasma fresco congelado, pero el volumen que se puede administrar de forma segura es limitado debido al peligro de sobrecarga de líquidos. La infusión de plasma sola no es tan beneficiosa como el recambio plasmático. Por lo general, se administran corticosteroides ( prednisona o prednisolona ). El rituximab , un anticuerpo monoclonal dirigido a la molécula CD20 en los linfocitos B , puede usarse en el diagnóstico; se cree que esto mata las células B y, por lo tanto, reduce la producción del inhibidor. Existe una recomendación más fuerte para el rituximab cuando la TTP no responde a los corticosteroides y la plasmaféresis.
El caplacizumab es una opción alternativa en el tratamiento de la PTT, ya que se ha demostrado que induce una resolución más rápida de la enfermedad en comparación con las personas que recibieron placebo. Sin embargo, el uso de caplacizumab se asoció con un aumento de la tendencia al sangrado en los sujetos estudiados.
Las personas con PTT refractaria o recidivante pueden recibir terapia inmunosupresora adicional , por ejemplo , vincristina , ciclofosfamida , ciclosporina A o esplenectomía .
Los niños con síndrome de Upshaw-Schülman reciben plasma profiláctico cada dos o tres semanas; esto mantiene niveles adecuados de funcionamiento de ADAMTS13. Algunos toleran intervalos más largos entre las infusiones de plasma. Pueden ser necesarias infusiones de plasma adicionales para desencadenar eventos, como cirugía; alternativamente, el recuento de plaquetas se puede controlar de cerca en torno a estos eventos y se administra plasma si el recuento desciende.
Las mediciones de los niveles sanguíneos de lactato deshidrogenasa , plaquetas y esquistocitos se utilizan para controlar la progresión o remisión de la enfermedad. La actividad de ADAMTS13 y los niveles de inhibidor se pueden medir durante el seguimiento, pero en aquellos sin síntomas no se recomienda el uso de rituximab.
Pronóstico
La tasa de mortalidad es de alrededor de 95% para los casos no tratados, pero el pronóstico es razonablemente favorable (80 a 90% de supervivencia) para las personas con PTT idiopática diagnosticada y tratada de manera temprana con plasmaféresis .
Epidemiología
La incidencia de TTP es de aproximadamente 4 a 5 casos por millón de personas por año. La PTT idiopática ocurre con mayor frecuencia en mujeres y personas de ascendencia africana, y la PTT secundaria a trastornos autoinmunitarios como el lupus eritematoso sistémico ocurre con mayor frecuencia en personas de ascendencia africana, aunque otras formas secundarias no muestran esta distribución. Las mujeres embarazadas y las mujeres en el período posparto representaron una parte notable (12-31%) de los casos en algunos estudios; La TTP afecta aproximadamente a uno de cada 25.000 embarazos.
Historia
La TTP fue descrita inicialmente por Eli Moschcowitz en el Hospital Beth Israel de la ciudad de Nueva York en 1925. Moschcowitz atribuyó la enfermedad (incorrectamente, como se conoce ahora) a una causa tóxica. Moschcowitz notó que su paciente, una niña de 16 años, tenía anemia, hematomas pequeños y grandes, hematuria microscópica y, en la autopsia, trombos microvasculares diseminados . En 1966, una revisión de 16 casos nuevos y 255 casos notificados anteriormente condujo a la formulación de la pentada clásica de síntomas y hallazgos (es decir, trombocitopenia, anemia hemolítica microangiopática, síntomas neurológicos, insuficiencia renal, fiebre); en esta serie, se encontró que las tasas de mortalidad eran muy altas (90%).
Si bien antes se había observado una respuesta a la transfusión de sangre, un informe de 1978 y los estudios posteriores mostraron que el plasma sanguíneo era muy eficaz para mejorar el proceso de la enfermedad. En 1991, se informó que el intercambio de plasma proporciona mejores tasas de respuesta en comparación con la infusión de plasma. En 1982, la enfermedad se había relacionado con multímeros del factor von Willebrand anormalmente grandes. La identificación de una proteasa deficiente en personas con PTT se realizó en 1998. La ubicación de ADAMTS13 dentro del genoma humano se identificó en 2001.
Referencias
enlaces externos
| Clasificación | |
|---|---|
| Recursos externos |

