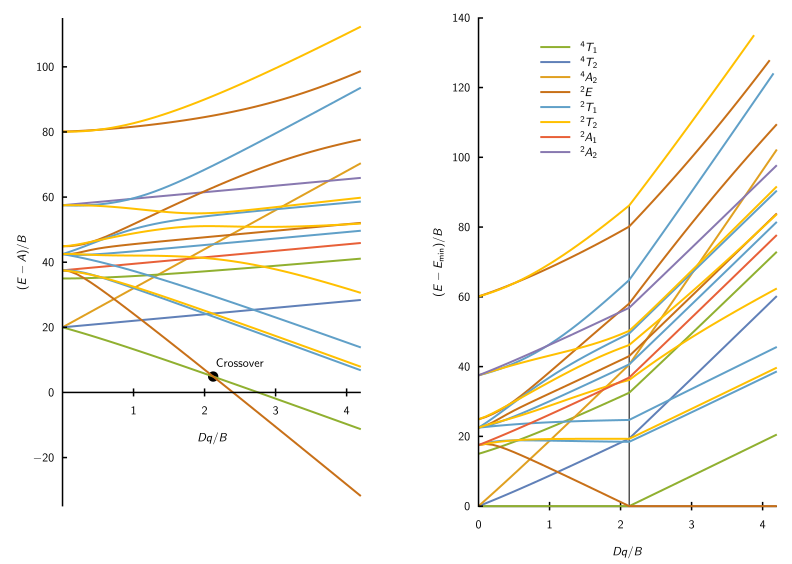Diagrama de Tanabe-Sugano - Tanabe–Sugano diagram
Los diagramas de Tanabe-Sugano se utilizan en química de coordinación para predecir absorciones en el espectro electromagnético UV, visible e IR de compuestos de coordinación . Los resultados de un análisis de diagrama de Tanabe-Sugano de un complejo metálico también se pueden comparar con datos espectroscópicos experimentales. Son cualitativamente útiles y se pueden usar para aproximar el valor de 10Dq, la energía de división del campo del ligando . Los diagramas de Tanabe-Sugano se pueden usar tanto para complejos de espín alto como de espín bajo, a diferencia de los diagramas de Orgel , que se aplican solo a complejos de espín alto. Los diagramas de Tanabe-Sugano también se pueden utilizar para predecir el tamaño del campo de ligando necesario para provocar transiciones de espín alto a espín bajo.
En un diagrama de Tanabe-Sugano, el estado fundamental se utiliza como referencia constante, en contraste con los diagramas de Orgel. La energía del estado fundamental se considera cero para todas las intensidades de campo, y las energías de todos los demás términos y sus componentes se representan con respecto al término fundamental.
Fondo
Hasta que Yukito Tanabe y Satoru Sugano publicaron su artículo "Sobre los espectros de absorción de iones complejos", en 1954, se sabía poco sobre los estados electrónicos excitados de los iones metálicos complejos . Utilizaron Hans Bethe 's teoría del campo cristalino y Giulio Racah ' combinaciones lineales s de las integrales Slater , ahora llamados parámetros Racah , para explicar los espectros de absorción de iones complejos octaédricos de una manera más cuantitativa que se habían alcanzado anteriormente. Después de muchos experimentos espectroscópicos, estimaron los valores de dos de los parámetros de Racah, B y C, para cada configuración de electrones d basándose en las tendencias en los espectros de absorción de los metales de transición isoelectrónicos de la primera fila . Las gráficas de las energías calculadas para los estados electrónicos de cada configuración electrónica ahora se conocen como diagramas de Tanabe-Sugano. El número debe ser adecuado para cada complejo de coordinación octaédrico, pero Tanabe y Sugano informaron números aproximados (orden de magnitud), tabulados a continuación. Tenga en cuenta que la relación C / B es aproximadamente de 4,5 para la mayoría de los iones. Esta relación cambia las energías relativas de los niveles en los diagramas de Tanabe-Sugano y, por lo tanto, los diagramas pueden variar ligeramente entre fuentes dependiendo de la relación C / B que se seleccionó al graficar.
| Ión divalente | Ion trivalente | ||||||
|---|---|---|---|---|---|---|---|
| Ion | B / cm –1 | C / cm –1 | C / B | Ion | B / cm –1 | C / cm –1 | C / B |
| Ti 2+ | 694 | 2910 | 4.19 | ||||
| V 2+ | 755 | 3257 | 4.31 | V 3+ | 861 | 3814 | 4.43 |
| Cr 2+ | 810 | 3565 | 4,40 | Cr 3+ | 918 | 4133 | 4.50 |
| Mn 2+ | 860 | 3850 | 4.48 | Mn 3+ | 965 | 4450 | 4.61 |
| Fe 2+ | 917 | 4040 | 4.41 | Fe 3+ | 1015 | 4800 | 4,73 |
| Co 2+ | 971 | 4497 | 4.63 | Co 3+ | 1065 | 5120 | 4.81 |
| Ni 2+ | 1030 | 4850 | 4,71 | Ni 3+ | 1115 | 5450 | 4.89 |
Parámetros
El eje x de un diagrama de Tanabe-Sugano se expresa en términos del parámetro de división del campo de ligando , Δ o Dq (para "diferencial de cuantos"), dividido por el parámetro B de Racah . El eje y está en términos de energía , E, también escalado por B. Existen tres parámetros Racah, A, B y C, que describen varios aspectos de la repulsión interelectrónica. A es una repulsión entre electrones total promedio. B y C se corresponden con repulsiones individuales de electrones d. A es constante entre la configuración de electrones d, y no es necesario para calcular energías relativas, de ahí su ausencia en los estudios de Tanabe y Sugano de iones complejos. C es necesario solo en ciertos casos. B es el más importante de los parámetros de Racah en este caso. Una línea corresponde a cada estado electrónico. La flexión de ciertas líneas se debe a la mezcla de términos con la misma simetría. Aunque las transiciones electrónicas solo están "permitidas" si la multiplicidad de espines sigue siendo la misma (es decir, los electrones no cambian de espín hacia arriba a hacia abajo o viceversa cuando se mueven de un nivel de energía a otro), los niveles de energía para estados electrónicos "con espín prohibido" están incluidos en los diagramas, que tampoco están incluidos en los diagramas de Orgel. A cada estado se le asigna su etiqueta de simetría molecular (por ejemplo, A 1g , T 2g , etc.), pero los subíndices "g" y "u" generalmente se omiten porque se entiende que todos los estados son gerade . Las etiquetas para cada estado generalmente se escriben en el lado derecho de la tabla, aunque para diagramas más complicados (por ejemplo, d 6 ) las etiquetas se pueden escribir en otras ubicaciones para mayor claridad. Los símbolos de término (por ejemplo, 3 P, 1 S, etc.) para un ión libre d n específico se enumeran, en orden de energía creciente, en el eje y del diagrama. El orden relativo de energías se determina usando las reglas de Hund . Para un complejo octaédrico, los símbolos de término de iones libres esféricos se dividen en consecuencia:
| Término | Degeneración | Estados en un campo octaédrico |
|---|---|---|
| S | 1 | Un 1g |
| PAG | 3 | T 1g |
| D | 5 | E g + T 2g |
| F | 7 | A 2g + T 1g + T 2g |
| GRAMO | 9 | A 1g + E g + T 1g + T 2g |
| H | 11 | E g + T 1g + T 1g + T 2g |
| I | 13 | A 1g + A 2g + E g + T 1g + T 2g + T 2g |
Ciertos diagramas de Tanabe-Sugano (d 4 , d 5 , d 6 yd 7 ) también tienen una línea vertical dibujada en un valor Dq / B específico, que se acompaña de una discontinuidad en las pendientes de los niveles de energía de los estados excitados. Este fruncimiento en las líneas ocurre cuando cambia la identidad del estado fundamental, como se muestra en el diagrama a continuación. La izquierda muestra las energías relativas de los estados iónicos d 7 como funciones de la intensidad del campo cristalino ( Dq ), mostrando una intersección de los estados 4 T 1 y 2 E cerca de Dq / B ~ 2.1. Restar la energía del estado fundamental produce el diagrama estándar de Tanabe-Sugano que se muestra a la derecha.
Este cambio de identidad generalmente ocurre cuando la energía de emparejamiento de espines, P, es igual a la energía de división del campo del ligando, Dq. Los complejos a la izquierda de esta línea (valores Dq / B más bajos) son de espín alto, mientras que los complejos a la derecha (valores Dq / B más altos) son de espín bajo. No existe una designación de giro bajo o alto para d 2 , d 3 o d 8 porque ninguno de los estados se cruza con energías razonables de campo de cristal.
Diagramas de Tanabe-Sugano
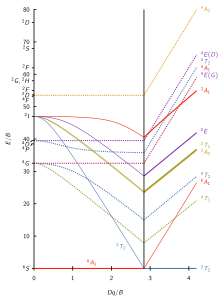
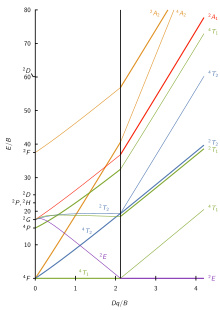
Los siete diagramas de Tanabe-Sugano para complejos octaédricos se muestran a continuación.
Diagramas innecesarios: d 1 , d 9 y d 10
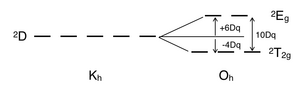
d 1
No hay repulsión de electrones en el complejo ad 1 , y el electrón individual reside en el estado fundamental orbital t 2g . A d 1 de metal octaédrico complejo, como [Ti (H 2 O) 6 ] 3+ , muestra una sola banda de absorción en un experimento de UV-vis. El término símbolo para d 1 es 2 D, que se divide en los estados 2 T 2g y 2 E g . El conjunto orbital t 2g contiene un solo electrón y tiene una energía de estado 2 T 2g de -4Dq. Cuando ese electrón se promueve a un orbital e g , se excita a la energía del estado 2 E g , + 6Dq. Esto está de acuerdo con la banda de absorción única en un experimento UV-vis. El hombro prominente en esta banda de absorción se debe a una distorsión de Jahn-Teller que elimina la degeneración de los dos estados 2 E g . Sin embargo, dado que estas dos transiciones se superponen en un espectro UV-vis, esta transición de 2 T 2g a 2 E g no requiere un diagrama de Tanabe-Sugano.
d 9
Similar a d 1 complejos metálicos, d 9 complejos metálicos octaédricos tienen 2 D término espectral. La transición es de la configuración (t 2g ) 6 (e g ) 3 (estado 2 E g ) a la configuración (t 2g ) 5 (e g ) 4 (estado 2 T 2g ). Esto también podría ser descrito como un "agujero" positiva que se mueve desde la e g a la t 2g conjunto orbital. El signo de Dq es opuesto al de d 1 , con un estado fundamental de 2 E g y un estado excitado de 2 T 2g . Al igual que el caso d 1 , los complejos octaédricos d 9 no requieren el diagrama de Tanabe-Sugano para predecir sus espectros de absorción.
d 10
No hay transiciones dd de electrones en d 10 complejos metálicos porque los orbitales d están completamente llenos. Por lo tanto, no se observan bandas de absorción de UV-vis y no existe un diagrama de Tanabe-Sugano.
Diagramas de simetría tetraédrica
Los diagramas tetraédricos de Tanabe-Sugano generalmente no se encuentran en los libros de texto porque el diagrama para ad n tetraédrico será similar al de d (10-n) octaédrico, recordando que Δ T para complejos tetraédricos es aproximadamente 4/9 de Δ O para un octaédrico complejo. Una consecuencia del tamaño mucho más pequeño de Δ T da como resultado que (casi) todos los complejos tetraédricos tengan un espín alto y, por lo tanto, el cambio en el término del estado fundamental que se ve en el eje X para los diagramas octaédricos d 4 -d 7 no es necesario para interpretar espectros. de complejos tetraédricos.
Ventajas sobre los diagramas de Orgel
En los diagramas de Orgel , la magnitud de la energía de división ejercida por los ligandos en los orbitales d, cuando un ion libre se acerca a un campo de ligando, se compara con la energía de repulsión de electrones, que son suficientes para proporcionar la ubicación de los electrones. Sin embargo, si la energía de división del campo del ligando, 10Dq, es mayor que la energía de repulsión de electrones, los diagramas de Orgel fallan al determinar la ubicación de los electrones. En este caso, los diagramas de Orgel están restringidos solo a complejos de alto espín.
Los diagramas de Tanabe-Sugano no tienen esta restricción y se pueden aplicar a situaciones en las que 10Dq es significativamente mayor que la repulsión de electrones. Por lo tanto, los diagramas de Tanabe-Sugano se utilizan para determinar la ubicación de electrones para complejos metálicos de alto y bajo giro. Sin embargo, están limitados porque solo tienen un significado cualitativo. Aun así, los diagramas de Tanabe-Sugano son útiles para interpretar los espectros UV-vis y determinar el valor de 10Dq.
Aplicaciones como herramienta cualitativa
En un campo de ligando centrosimétrico, como en los complejos octaédricos de metales de transición, la disposición de los electrones en el orbital d no solo está limitada por la energía de repulsión de electrones, sino que también está relacionada con la división de los orbitales debido al campo de ligando. Esto conduce a muchos más estados de configuración de electrones que en el caso del ion libre. La energía relativa de la energía de repulsión y la energía de división define los estados de alto y bajo giro .
Teniendo en cuenta los campos de ligandos fuertes y débiles, un diagrama de Tanabe-Sugano muestra la división de energía de los términos espectrales con el aumento de la intensidad del campo de ligando. Es posible que entendamos cómo se distribuye la energía de los diferentes estados de configuración con ciertas fuerzas de ligando. La restricción de la regla de selección de giro hace que sea aún más fácil predecir las posibles transiciones y su intensidad relativa. Aunque son cualitativos, los diagramas de Tanabe-Sugano son herramientas muy útiles para analizar los espectros UV-vis: se utilizan para asignar bandas y calcular los valores de Dq para la división del campo de ligando.
Ejemplos de
Manganeso (II) hexahidrato
En el complejo metálico [Mn (H 2 O) 6 ] 2+ , el manganeso tiene un estado de oxidación de +2, por lo que es un ion ad 5 . El H 2 O es un ligando de campo débil (el espectro se muestra a continuación) y, según el diagrama de Tanabe-Sugano para iones d 5 , el estado fundamental es 6 A 1 . Tenga en cuenta que no hay multiplicidad de espín de sexteto en ningún estado excitado, por lo que se espera que las transiciones desde este estado fundamental estén prohibidas y que las intensidades de banda sean bajas. A partir de los espectros, solo se observan bandas de muy baja intensidad (valores de absortividad molar baja (ε) en el eje y).
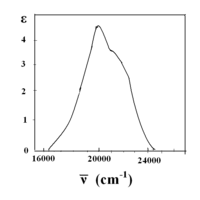
Cobalto (II) hexahidrato
Otro ejemplo es [Co (H 2 O) 6 ] 2+ . Tenga en cuenta que el ligando es el mismo que en el último ejemplo. Aquí el ion cobalto tiene el estado de oxidación de +2, y es un ion ad 7 . Desde el lado de espín alto (izquierda) del diagrama d 7 Tanabe-Sugano, el estado fundamental es 4 T 1 (F) y la multiplicidad de espín es un cuarteto. El diagrama muestra que hay tres cuarteto de estados excitados: 4 T 2 , 4 A 2 y 4 T 1 (P). A partir del diagrama, se puede predecir que hay tres transiciones con giro permitido. Sin embargo, los espectros de [Co (H 2 O) 6 ] 2+ no muestran tres picos distintos que correspondan a los tres estados excitados previstos. En cambio, el espectro tiene un pico amplio (el espectro se muestra a continuación). Según el diagrama T – S, la transición de energía más baja es 4 T 1 a 4 T 2 , que se ve en el IR cercano y no se observa en el espectro visible. El pico principal es la transición de energía 4 T 1 (F) a 4 T 1 (P), y se predice que la transición de energía ligeramente más alta (el hombro) será de 4 T 1 a 4 A 2 . La pequeña diferencia de energía conduce a la superposición de los dos picos, lo que explica el pico ancho observado en el espectro visible.
Resolviendo para B y Δ O
Para el complejo d 2 [V (H 2 O) 6 ] 3+ , se observan dos bandas con máximos en torno a 17.500 y 26.000 cm −1 . La relación de las energías de la banda experimental es E (ν 2 ) / E (ν 1 ) es 1,49. Se esperan tres posibles transiciones, que incluyen: ν 1 : 3 T 1g → 3 T 2g , ν 2 : 3 T 1g → 3 T 1g (P) y ν 3 : 3 T 1g → 3 A 2g . Hay tres posibles transiciones, pero solo se observan dos, por lo que se debe determinar la transición no observada.
| Δ O / B = | 10 | 20 | 30 | 40 |
|---|---|---|---|---|
| Altura E (ν 1 ) / B | 10 | 19 | 28 | 37 |
| Altura E (ν 2 ) / B | 23 | 33 | 42 | 52 |
| Altura E (ν 3 ) / B | 19 | 38 | 56 | 75 |
| Relación E (ν 3 ) / E (ν 1 ) | 1,9 | 2.0 | 2.0 | 2.0 |
| Relación E (ν 2 ) / E (ν 1 ) | 2.3 | 1,73 | 1,5 | 1.4 |
Complete una tabla como la de la derecha encontrando las alturas correspondientes (E / B) de los estados de simetría en ciertos valores de Δ O / B. Luego, encuentre la razón de estos valores (E (ν 2 ) / E (ν 1 ) y E (ν 3 ) / E (ν 1 )). Tenga en cuenta que la relación de E (ν 3 ) / E (ν 1 ) no contiene la relación calculada para la energía de la banda experimental, por lo que podemos determinar que la banda 3 T 1g → 3 A 2g no se observa. Utilice relaciones para E (ν 2 ) / E (ν 1 ) y los valores de Δ O / B para trazar una línea con E (ν 2 ) / E (ν 1 ) siendo los valores y y Δ O / B siendo el valores x. Usando esta línea, es posible determinar el valor de Δ O / B para la relación experimental. (Δ O / B = 3,1 para una relación de gráfico de 1,49 en este ejemplo).
Encuentre en el diagrama T – S donde Δ O / B = 3.1 para 3 T 1g → 3 T 2g y 3 T 1g → 3 T 1g (P). Para 3 T 2g , E (ν 1 ) / B = 27 y para 3 T 1g (P), E (ν 2 ) / B = 43.
El parámetro Racah se puede encontrar calculando B a partir de E (ν 2 ) y E (ν 1 ). Para 3 T 1g (P), B = 26.000 cm −1 / 43 = 604 cm −1 . Para 3 T 2g , B = 17,500 cm −1 / 27 = 648 cm −1 . A partir del valor medio del parámetro Racah , se puede encontrar el parámetro de división del campo del ligando (Δ O ). Si Δ O / B = 3,1 y B = 625 cm -1 , entonces Δ O = 19 375 cm -1 .