Sulfonamida - Sulfonamide
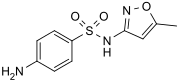
En química , el grupo funcional sulfonamida (también deletreado sulfonamida ) es -S (= O) 2 -NH 2 , un grupo sulfonilo conectado a un grupo amina . En términos relativos, este grupo no es reactivo. El centro de amina ya no es básico. El enlace SN se escinde solo con dificultad. Debido a la rigidez del grupo funcional, las sulfonamidas son típicamente cristalinas. Por esta razón, la formación de una sulfonamida es un método clásico para convertir una amina en un derivado cristalino que se puede identificar por su punto de fusión. Muchos medicamentos importantes contienen el grupo de las sulfonamidas.
Una sulfonamida (compuesto) es un compuesto que contiene este grupo. La fórmula general es RSO 2 NH 2 , donde R es algún grupo orgánico. Por ejemplo, "metanosulfonamida" es CH 3 SO 2 NH 2 . Se puede considerar que cualquier sulfonamida deriva de un ácido sulfónico reemplazando un grupo hidroxilo por un grupo amina. En medicina , el término "sulfonamida" se utiliza a veces como sinónimo de sulfamida , un derivado o variación de la sulfanilamida. La primera sulfonamida se descubrió en Alemania en 1932.
Síntesis
Las sulfonamidas se pueden preparar en el laboratorio de muchas formas. El enfoque clásico implica la reacción de cloruros de sulfonilo con una amina .
- RSO 2 Cl + R 2 NH → RSO 2 NR 2 + HCl
Por lo general, se agrega una base como la piridina para absorber el HCl que se genera. Es ilustrativa la síntesis de sulfonilmetilamida. Una fuente de cloruro de sulfonilo fácilmente disponible es el cloruro de tosilo . La reacción de aminas primarias y secundarias con cloruro de bencenosulfonilo es la base de la reacción de Hinsberg , un método para detectar aminas primarias y secundarias.
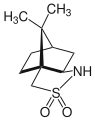
Sultamas
Los sultamas son sulfonamidas cíclicas. Los sultamas bioactivos incluyen el antiinflamatorio ampiroxicam y el anticonvulsivo sultiame . Los sultamas se preparan de forma análoga a otras sulfonamidas, teniendo en cuenta el hecho de que los ácidos sulfónicos son desprotonados por las aminas. A menudo se preparan mediante oxidación en un solo recipiente de disulfuros o tioles unidos a aminas. Una síntesis alternativa de sultamas implica la preparación inicial de una sulfonamida lineal, seguida de la formación de enlaces CC intramoleculares (es decir, ciclación), una estrategia que se utilizó en la síntesis de un emisor azul profundo basado en sultamas para la electrónica orgánica.
- Compuestos a base de sulfonamidas
La sacarina , una sulfonamida cíclica que fue uno de los primeros edulcorantes artificiales descubiertos.
Sulfanilamida , un compuesto que presagió el desarrollo de sulfamidas.
El sulfametoxazol es un antibiótico ampliamente utilizado .
El ampiroxicam es un sultama que se utiliza como fármaco antiinflamatorio.
La hidroclorotiazida es un fármaco que presenta grupos sulfonamidas tanto acíclicos como cíclicos.
El alcanforsultama es un sultama que se utiliza como auxiliar quiral en la síntesis orgánica.
Sulfinamidas
Las sulfinamidas relacionadas (R (S = O) NHR) son amidas de ácidos sulfínicos (R (S = O) OH) (ver sulfinilo ). Las sulfinamidas quirales como la terc-butanosulfinamida , la p-toluenosulfinamida y la 2,4,6-trimetilbencenosulfinamida son importantes para la síntesis asimétrica .
Disulfonimidas
La bis (trifluorometanosulfonil) anilina es una fuente del grupo triflilo (CF 3 SO 2 + ).
Las disulfonimidas son del tipo RS (= O) 2 -N (H) -S (= O) 2 -R 'con dos grupos sulfonilo flanqueando una amina. Al igual que con las sulfinamidas, esta clase de compuestos se utiliza como catalizadores en la síntesis enantioselectiva.