Átomo de Rydberg - Rydberg atom

Un átomo de Rydberg es un átomo excitado con uno o más electrones que tienen un número cuántico principal muy alto , n . Cuanto mayor sea el valor de n , más lejos está el electrón del núcleo, en promedio . Los átomos de Rydberg tienen una serie de propiedades peculiares que incluyen una respuesta exagerada a los campos eléctricos y magnéticos , largos períodos de desintegración y funciones de onda de los electrones que se aproximan, en algunas condiciones, a las órbitas clásicas de los electrones alrededor de los núcleos . Los electrones del núcleo protegen el electrón externo del campo eléctrico del núcleo de modo que, desde la distancia, el potencial eléctrico parece idéntico al experimentado por el electrón en un átomo de hidrógeno .
A pesar de sus deficiencias, el modelo de Bohr del átomo es útil para explicar estas propiedades. Clásicamente, un electrón en una órbita circular de radio r , alrededor de un núcleo de hidrógeno de carga + e , obedece a la segunda ley de Newton :
donde k = 1 / (4π ε 0 ).
El momento orbital se cuantifica en unidades de ħ :
- .
La combinación de estas dos ecuaciones conduce a la expresión de Bohr para el radio orbital en términos del número cuántico principal , n :
Ahora es evidente por qué los átomos de Rydberg tienen propiedades tan peculiares: el radio de la órbita se escala como n 2 (el estado n = 137 del hidrógeno tiene un radio atómico ~ 1 µm) y la sección transversal geométrica como n 4 . Así, los átomos de Rydberg son extremadamente grandes con electrones de valencia débilmente unidos , fácilmente perturbados o ionizados por colisiones o campos externos.
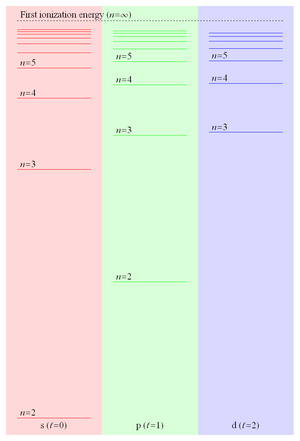
Debido a que la energía de enlace de un electrón de Rydberg es proporcional a 1 / r y, por lo tanto, cae como 1 / n 2 , el espaciado de niveles de energía cae como 1 / n 3, lo que lleva a niveles cada vez más espaciados que convergen en la primera energía de ionización . Estos estados de Rydberg estrechamente espaciados forman lo que comúnmente se conoce como la serie de Rydberg . La Figura 2 muestra algunos de los niveles de energía de los tres valores más bajos del momento angular orbital en el litio .
Historia
La existencia de la serie de Rydberg se demostró por primera vez en 1885 cuando Johann Balmer descubrió una fórmula empírica simple para las longitudes de onda de la luz asociadas con las transiciones en el hidrógeno atómico . Tres años más tarde, el físico sueco Johannes Rydberg presentó una versión generalizada y más intuitiva de la fórmula de Balmer que llegó a conocerse como la fórmula de Rydberg . Esta fórmula indicó la existencia de una serie infinita de niveles de energía discretos cada vez más espaciados que convergen en un límite finito.
Esta serie fue explicada cualitativamente en 1913 por Niels Bohr con su modelo semiclásico del átomo de hidrógeno en el que los valores cuantificados del momento angular conducen a los niveles de energía discretos observados. Wolfgang Pauli en 1926 obtuvo una derivación cuantitativa completa del espectro observado tras el desarrollo de la mecánica cuántica por Werner Heisenberg y otros.
Métodos de producción
El único estado verdaderamente estable de un átomo similar al hidrógeno es el estado fundamental con n = 1. El estudio de los estados de Rydberg requiere una técnica confiable para excitar los átomos del estado fundamental a estados con un gran valor de n .
Excitación por impacto de electrones
Gran parte del trabajo experimental inicial sobre átomos de Rydberg se basó en el uso de haces colimados de electrones rápidos incidentes en átomos en estado fundamental. Los procesos de dispersión inelástica pueden usar la energía cinética de los electrones para aumentar la energía interna de los átomos excitando a una amplia gama de estados diferentes, incluidos muchos estados de Rydberg elevados,
- .
Debido a que el electrón puede retener cualquier cantidad arbitraria de su energía cinética inicial, este proceso siempre da como resultado una población con una amplia dispersión de energías diferentes.
Excitación de intercambio de carga
Otro pilar de los primeros experimentos con átomos de Rydberg se basó en el intercambio de carga entre un haz de iones y una población de átomos neutros de otra especie, lo que resultó en la formación de un haz de átomos muy excitados.
- .
Nuevamente, debido a que la energía cinética de la interacción puede contribuir a las energías internas finales de los constituyentes, esta técnica puebla una amplia gama de niveles de energía.
Excitación óptica
La llegada de los láseres de tinte sintonizable en la década de 1970 permitió un nivel mucho mayor de control sobre las poblaciones de átomos excitados. En la excitación óptica, el fotón incidente es absorbido por el átomo objetivo, especificando absolutamente la energía del estado final. El problema de producir poblaciones monoenergéticas de un solo estado de átomos de Rydberg se convierte así en el problema algo más simple de controlar con precisión la frecuencia de la salida del láser.
- .
Esta forma de excitación óptica directa se limita generalmente a experimentos con metales alcalinos , porque la energía de enlace del estado fundamental en otras especies es generalmente demasiado alta para ser accesible con la mayoría de los sistemas láser.
Para los átomos con una gran energía de enlace de electrones de valencia (equivalente a una gran primera energía de ionización ), los estados excitados de la serie Rydberg son inaccesibles con los sistemas láser convencionales. La excitación de colisión inicial puede compensar el déficit de energía, lo que permite utilizar la excitación óptica para seleccionar el estado final. Aunque el paso inicial excita a una amplia gama de estados intermedios, la precisión inherente al proceso de excitación óptica significa que la luz láser solo interactúa con un subconjunto específico de átomos en un estado particular, excitando al estado final elegido.
Potencial hidrogénico
Un átomo en un estado de Rydberg tiene un electrón de valencia en una órbita grande lejos del núcleo del ión; en una órbita tal, el electrón más exterior siente una casi hidrogenoides , Coulomb potencial , U C a partir de un núcleo de iones compacta que consiste en un núcleo con Z protones y las capas de electrones inferiores llenos de Z -1 electrones. Un electrón en el potencial de Coulomb de simetría esférica tiene energía potencial:
- .
La similitud del potencial efectivo "visto" por el electrón externo con el potencial de hidrógeno es una característica definitoria de los estados de Rydberg y explica por qué las funciones de onda de los electrones se aproximan a las órbitas clásicas en el límite del principio de correspondencia . En otras palabras, la órbita del electrón se asemeja a la órbita de los planetas dentro de un sistema solar, similar a lo que se vio en los obsoletos pero visualmente útiles modelos de Bohr y Rutherford del átomo.
Hay tres excepciones notables que se pueden caracterizar por el término adicional agregado a la energía potencial:
- Un átomo puede tener dos (o más) electrones en estados muy excitados con radios orbitales comparables. En este caso, la interacción electrón-electrón da lugar a una desviación significativa del potencial de hidrógeno. Para un átomo en un estado de Rydberg múltiple, el término adicional, U ee , incluye una suma de cada par de electrones altamente excitados:
- .
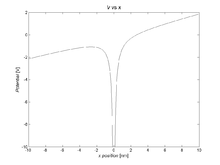
- Si el electrón de valencia tiene un momento angular muy bajo (interpretado clásicamente como una órbita elíptica extremadamente excéntrica ), entonces puede pasar lo suficientemente cerca para polarizar el núcleo iónico, dando lugar a un término de polarización del núcleo de 1 / r 4 en el potencial. La interacción entre un dipolo inducido y la carga que lo produce siempre es atractiva por lo que esta contribución es siempre negativa,
- ,
- donde α d es la polarizabilidad del dipolo . La Figura 3 muestra cómo el término de polarización modifica el potencial cercano al núcleo.
- Si el electrón externo penetra en las capas internas de electrones, “verá” más carga del núcleo y, por lo tanto, experimentará una fuerza mayor. En general, la modificación de la energía potencial no es sencilla de calcular y debe basarse en el conocimiento de la geometría del núcleo iónico.
Detalles de la mecánica cuántica
Mecánicamente cuántico, un estado con n anormalmente alto se refiere a un átomo en el que los electrones de valencia se han excitado en un orbital de electrones anteriormente despoblado con mayor energía y menor energía de enlace . En el hidrógeno, la energía de enlace viene dada por:
- ,
donde Ry = 13,6 eV es la constante de Rydberg . La baja energía de enlace a valores altos de n explica por qué los estados de Rydberg son susceptibles a la ionización.
Términos adicionales en la expresión de la energía potencial para un estado de Rydberg, además de la energía potencial hidrógena de Coulomb, requieren la introducción de un defecto cuántico , δ l , en la expresión de la energía de enlace:
- .
Funciones de onda de electrones
La larga vida útil de los estados de Rydberg con alto momento angular orbital se puede explicar en términos de superposición de funciones de onda. La función de onda de un electrón en un estado l elevado (momento angular elevado, "órbita circular") se superpone muy poco con las funciones de onda de los electrones internos y, por tanto, permanece relativamente imperturbable.
Las tres excepciones a la definición de un átomo de Rydberg como un átomo con potencial hidrogénico, tienen una descripción mecánica cuántica alternativa que puede caracterizarse por los términos adicionales en el hamiltoniano atómico :
- Si un segundo electrón se excita a un estado n i , energéticamente cercano al estado del electrón externo n o , entonces su función de onda se vuelve casi tan grande como la del primero (un estado doble de Rydberg). Esto ocurre cuando n i se acerca a n o y conduce a una condición en la que el tamaño de las órbitas de los dos electrones está relacionado; una condición a la que a veces se hace referencia como correlación radial . Se debe incluir un término de repulsión electrón-electrón en el hamiltoniano atómico.
- La polarización del núcleo de iones produce un potencial anisotrópico que provoca una correlación angular entre los movimientos de los dos electrones más externos. Esto se puede considerar como un efecto de bloqueo de marea debido a un potencial simétrico no esférico. Se debe incluir un término de polarización del núcleo en el hamiltoniano atómico.
- La función de onda del electrón externo en estados con un momento angular orbital bajo l , se localiza periódicamente dentro de las capas de electrones internos e interactúa con la carga completa del núcleo. La Figura 4 muestra una interpretación semiclásica de los estados de momento angular en un orbital de electrones, lo que ilustra que los estados l bajos pasan más cerca del núcleo y penetran potencialmente en el núcleo del ión. Se debe agregar un término de penetración del núcleo al hamiltoniano atómico.
En campos externos
La gran separación entre el electrón y el núcleo de iones en un átomo de Rydberg hace posible un momento dipolar eléctrico extremadamente grande , d . Hay una energía asociada con la presencia de un dipolo eléctrico en un campo eléctrico , F , conocido en física atómica como cambio Stark ,
Dependiendo del signo de la proyección del momento dipolar sobre el vector de campo eléctrico local, un estado puede tener energía que aumenta o disminuye con la intensidad del campo (estados de búsqueda de campo bajo y campo alto, respectivamente). El estrecho espacio entre n niveles adyacentes en la serie de Rydberg significa que los estados pueden acercarse a la degeneración incluso para intensidades de campo relativamente modestas. La intensidad de campo teórica a la que se produciría un cruce suponiendo que no haya acoplamiento entre los estados viene dada por el límite de Inglis-Teller ,
En el átomo de hidrógeno , el potencial de Coulomb 1 / r puro no acopla los estados Stark de los n- múltiples adyacentes, lo que da como resultado cruces reales, como se muestra en la figura 5 . La presencia de términos adicionales en la energía potencial puede conducir a un acoplamiento que resulte en cruces evitados como se muestra para el litio en la figura 6 .
Aplicaciones e investigación adicional
Medidas de precisión de átomos de Rydberg atrapados
La vida útil de la desintegración radiativa de los átomos en estados metaestables al estado fundamental es importante para comprender las observaciones y pruebas astrofísicas del modelo estándar.
Investigando los efectos diamagnéticos
Los tamaños grandes y bajas energías de enlace de los átomos de Rydberg conducen a una alta susceptibilidad magnética , . A medida que los efectos diamagnéticos se escalan con el área de la órbita y el área es proporcional al radio al cuadrado ( A ∝ n 4 ), los efectos imposibles de detectar en los átomos en estado fundamental se vuelven obvios en los átomos de Rydberg, que demuestran cambios diamagnéticos muy grandes.
Los átomos de Rydberg exhiben un fuerte acoplamiento dipolo eléctrico de los átomos a los campos electromagnéticos y se han utilizado para detectar comunicaciones por radio.
En plasmas
Los átomos de Rydberg se forman comúnmente en los plasmas debido a la recombinación de electrones e iones positivos; La recombinación de baja energía da como resultado átomos de Rydberg bastante estables, mientras que la recombinación de electrones e iones positivos con alta energía cinética a menudo forma estados de Rydberg autoionizantes . El gran tamaño de los átomos de Rydberg y su susceptibilidad a la perturbación e ionización por campos eléctricos y magnéticos son un factor importante que determina las propiedades de los plasmas.
La condensación de los átomos de Rydberg forma la materia de Rydberg , que se observa con mayor frecuencia en forma de grupos de larga duración. La desexcitación se ve obstaculizada significativamente en la materia de Rydberg por los efectos de correlación de intercambio en el líquido electrónico no uniforme formado por la condensación por los electrones de valencia colectivos, lo que provoca una vida útil prolongada de los grupos.
En astrofísica
Se ha sugerido que los átomos de Rydberg son comunes en el espacio interestelar y podrían observarse desde la Tierra. Dado que la densidad dentro de las nubes de gas interestelar es muchos órdenes de magnitud más baja que los mejores vacíos de laboratorio alcanzables en la Tierra, los estados de Rydberg podrían persistir durante largos períodos de tiempo sin ser destruidos por colisiones.
Sistemas que interactúan fuertemente
Debido a su gran tamaño, los átomos de Rydberg pueden exhibir momentos dipolares eléctricos muy grandes . Los cálculos que utilizan la teoría de la perturbación muestran que esto da como resultado fuertes interacciones entre dos átomos de Rydberg cercanos. El control coherente de estas interacciones combinado con su vida relativamente larga los convierte en candidatos adecuados para realizar una computadora cuántica . En 2010 se lograron de forma experimental puertas de dos qubits . Los átomos de Rydberg que interactúan fuertemente también presentan un comportamiento crítico cuántico , lo que los hace interesantes de estudiar por sí mismos.
Direcciones de investigación actuales
Desde la investigación de los átomos de Rydberg de 2000 abarca, en términos generales, tres direcciones: detección, óptica cuántica, computación cuántica y simulación cuántica . Los momentos dipolares eléctricos elevados entre los estados atómicos de Rydberg se utilizan para la detección e imagen de radiofrecuencia y terahercios , incluidas las mediciones sin demolición de fotones de microondas individuales. La transparencia inducida electromagnéticamente se usó en combinación con interacciones fuertes entre dos átomos excitados en el estado de Rydberg para proporcionar un medio que exhibe un comportamiento fuertemente no lineal a nivel de fotones ópticos individuales. La interacción sintonizable entre los estados de Rydberg permitió también los primeros experimentos de simulación cuántica.
En octubre de 2018, el Laboratorio de Investigación del Ejército de los Estados Unidos discutió públicamente los esfuerzos para desarrollar un receptor de radio de banda súper ancha utilizando átomos de Rydberg. En marzo de 2020, el laboratorio anunció que sus científicos analizaron la sensibilidad del sensor Rydberg a los campos eléctricos oscilantes en un rango enorme de frecuencias, de 0 a 10 ^ 12 Hertz (el espectro a una longitud de onda de 0,3 mm). El sensor Rydberg puede detectar señales de manera confiable en todo el espectro y comparar favorablemente con otras tecnologías establecidas de sensores de campo eléctrico, como cristales electroópticos y electrónica pasiva acoplada a antena dipolo.
Simulación clásica

Un potencial 1 / r simple da como resultado una órbita elíptica kepleriana cerrada . En presencia de un campo eléctrico externo, los átomos de Rydberg pueden obtener momentos dipolares eléctricos muy grandes , lo que los hace extremadamente susceptibles a la perturbación del campo. La Figura 7 muestra cómo la aplicación de un campo eléctrico externo (conocido en física atómica como campo Stark ) cambia la geometría del potencial, cambiando drásticamente el comportamiento del electrón. Un potencial de Coulombic no aplica ningún torque ya que la fuerza siempre es antiparalela al vector de posición (siempre apuntando a lo largo de una línea que corre entre el electrón y el núcleo):
- ,
- .
Con la aplicación de un campo eléctrico estático, el electrón siente un par que cambia continuamente. La trayectoria resultante se vuelve progresivamente más distorsionada con el tiempo, pasando eventualmente a través del rango completo de momento angular desde L = L MAX , a una línea recta L = 0, a la órbita inicial en el sentido opuesto L = - L MAX .
El período de tiempo de la oscilación en el momento angular (el tiempo para completar la trayectoria en la figura 8 ), coincide casi exactamente con el período predicho mecánicamente cuánticamente para que la función de onda regrese a su estado inicial, lo que demuestra la naturaleza clásica del átomo de Rydberg.