Expansión y contracción del anillo - Ring expansion and contraction
Las reacciones de expansión y contracción del anillo en el curso de la síntesis orgánica se refieren a un conjunto de reacciones que pueden conducir a la expansión o contracción de un anillo existente . Esto a menudo hace posible acceder a estructuras que serían difíciles, si no imposibles, de sintetizar con reacciones de ciclación únicas . Las expansiones de anillos son valiosas porque permiten el acceso a sistemas más grandes que son difíciles de sintetizar a través de una sola ciclación debido a la lenta velocidad de formación. Las contracciones de anillo son útiles para hacer anillos más pequeños y tensos a partir de anillos más grandes. Las expansiones se clasifican por el mecanismo de expansión y el átomo (s) agregado (s); las contracciones se caracterizan simplemente por el intermedio reactivo que realiza la contracción.
Descripción
En el curso de una síntesis orgánica , un químico a menudo necesita formar un anillo nuevo o alterar uno existente. Las reacciones de expansión y contracción del anillo se utilizan para expandir o contraer un anillo existente , lo que a menudo hace posible acceder a estructuras que serían difíciles, si no imposibles, de sintetizar con reacciones de ciclación únicas .
Reacciones de expansión del anillo
Las expansiones de anillos son valiosas porque permiten el acceso a sistemas más grandes que son difíciles de sintetizar a través de una sola ciclación debido a la lenta velocidad de formación (anillos de siete miembros y más grandes). La clasificación de las expansiones del anillo por el mecanismo de expansión y el átomo (s) agregado permite ver las similitudes entre los diferentes métodos de expansión y los diferentes átomos incorporados. La clasificación más amplia proviene del mecanismo de expansión. Los anillos se pueden expandir atacando el anillo a un grupo exterior ya adjunto al anillo (una migración / inserción), abriendo una bicicleta a un solo anillo más grande o acoplando un cierre del anillo con una expansión. Estas expansiones se pueden descomponer aún más según el tipo de átomo que incorporan (un carbono o un heteroátomo) en el anillo expandido.
Reacciones de inserción de carbono
Las inserciones de carbono son reacciones tremendamente útiles que introducen un átomo de carbono adicional en el anillo. Estas reacciones se utilizan en la síntesis de muchos fármacos y productos naturales. Estos pueden proceder a través de cualquiera de los mecanismos que se enumeran a continuación.
Inserción de carbono a través de la migración a un grupo exocíclico
Estas reacciones tienen las características generales de tener un grupo saliente exocíclico en un carbono adyacente al anillo y un grupo donador de electrones en el anillo capaz de iniciar una migración de un enlace endocíclico.
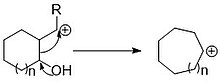
Una introducción de migración común de carbono es una transposición de pinacol . Si bien esta reacción se refiere específicamente a un reordenamiento de dihidróxido vecinal, existen otros reordenamientos de tipo pinacol que proceden a través del mismo mecanismo general, como el reordenamiento de Tiffeneau-Demjanov . Estos "reordenamientos de semipinacol" se producen en condiciones más suaves y, por tanto, son preferibles en síntesis complejas. Estas reacciones son útiles más allá de simplemente expandir un anillo porque el grupo exocíclico atacado también puede tener otras funciones agregadas además del grupo saliente. El grupo al que migra el enlace endocíclico también se puede agregar selectivamente al anillo en base a la funcionalidad ya presente, por ejemplo, la adición 1,2 en una cetona cíclica.
Inserción de carbono a través de la apertura de una bicicleta.
La introducción de carbono a través de la apertura de un sistema bicíclico es otra forma de introducir un solo carbono o varios a la vez en un anillo. La introducción de un solo carbono a menudo pasa por un ciclopropano que contiene un intermedio bicíclico, que posteriormente se abre para dar el anillo expandido. La expansión puede ocurrir a través de una apertura de anillo electrocíclico o por una ruptura inducida del enlace compartido.
Estas reacciones se diferencian en términos de cómo se agrega el carbono para formar el anillo de ciclopropano. Se puede usar una reacción similar a la de Simmons-Smith con un anillo que contiene alqueno para introducir un solo carbono. Existen otros métodos para ciclopropantar otras funcionalidades, como la expansión del anillo de Buchner para el ataque nucleófilo (A) y la donación del grupo vecino (B). La formación del anillo de ciclopropano en una sola expansión de carbono permite la introducción de una funcionalidad adicional junto con la expansión del anillo, siempre que la funcionalidad adicional se agregue al carbón que se inserta. El objetivo de la ciclopropanación también varía según las condiciones utilizadas. La reacción de Simmons-Smith se suma a los alquenos, mientras que la expansión del anillo de Buchner permite la adición a arenos típicamente no reactivos. La expansión del anillo de Buchner es útil porque da cicloheptatrienos como productos abiertos del anillo, que se encuentran en el núcleo de algunos productos naturales, como los azulenos. Una consideración importante en estas expansiones de anillo es la apertura del anillo a un anillo expandido y no un grupo exocíclico en el anillo original o un producto que no se puede abrir. Se estimula la expansión del anillo de Buchner para que se abra al producto deseado colocando grupos extractores de electrones en el carbono agregado. Para realizar la apertura del anillo sobre moléculas bicíclicas saturadas se debe introducir el ciclopropano de manera que un grupo vecino pueda facilitar la expansión o el anillo debe abrirse atacando la expansión o el anillo debe abrirse por ataque de un grupo externo.
La apertura del anillo como medio de expansión del anillo también se puede aplicar a sistemas más grandes para dar acceso a una siciclación del anillo aún mayor. La fragmentación de Grob se puede aplicar como ejemplo de tal expansión. Al igual que la migración de tipo pinacol, la fragmentación de Grob se basa en un grupo donante de electrones para promover la migración del enlace y estimular la expulsión del grupo saliente. En este caso, el grupo donador de electrones puede ser un pseudo grupo donador de electrones que es capaz de eliminar y donar un par de electrones en el carbono con la ruptura del enlace. Trabajar con dos anillos más pequeños puede permitir la elaboración de dos partes de la molécula por separado antes de trabajar con el anillo expandido. La expansión de anillo Dowd-Beckwith también es capaz de agregar varios carbonos a un anillo a la vez, e de agregar varios carbonos a un anillo a la vez, y es una herramienta útil para hacer anillos grandes. Mientras avanza a través de una bicicleta intermedia, la ciclación final y la apertura del anillo tienen lugar dentro de la misma reacción radical . Esta expansión es útil porque permite la expansión de un beta-cetoéster a una cetona cíclica grande que puede elaborarse fácilmente usando la cetona cíclica o el éster exocíclico.
Reacciones de inserción de heteroátomos
Las adiciones de heteroátomos a los anillos pueden ocurrir a través de expansiones de anillos, si no se realizan a través de la síntesis de anillos de novo. Estas introducciones son principalmente expansiones de anillo porque a menudo tienen lugar a través de rutas de migración / inserción similares a las mencionadas anteriormente para el carbono. Los ejemplos incluyen aplicaciones de alto impacto de la transposición de Beckmann (para la introducción de nitrógeno en la codeína) y la oxidación de Baeyer-Villiger (introducción de oxígeno a éteres anulados en jaulas) en síntesis. Ambos ocurren con la expulsión de un grupo saliente cuando el grupo alquilo migra al heteroátomo exocíclico, que es sorprendentemente similar al reordenamiento de tipo pinacol.
Reacciones de contracción del anillo
Las contracciones de anillo son útiles para hacer anillos más pequeños y tensos a partir de anillos más grandes. El ímpetu para hacer estos anillos proviene de la dificultad asociada con hacer un anillo pequeño completamente elaborado cuando dicho anillo podría hacerse más fácilmente a partir de un anillo elaborado más grande, del cual se puede extirpar un átomo, o que el andamio original más grande es más accesible. .
Las contracciones de anillo se caracterizan fácilmente simplemente por el intermedio reactivo que realiza la contracción. Los intermedios estándar son aniónicos, catiónicos y carbenoides.
Contracciones aniónicas
El reordenamiento de Favorskii es el hijo del cartel de las contracciones del anillo aniónico. Procede a través de un carbanión que ataca a un carbono endocíclico y expulsa un grupo saliente (un haluro) formando una molécula bicíclica con anillos más pequeños que el original. Luego, la bicicleta se abre mediante un ataque nucleofílico a la cetona para dar el producto contraído.
Una alternativa al reordenamiento estándar de Favorskii es realizar lo que se puede pensar como un reordenamiento negativo de pinacol donde un grupo aniónico estimula un enlace alineado con un grupo saliente para migrar y expulsar el grupo saliente, que se ha utilizado en varias síntesis. También debe tenerse en cuenta que la llamada "transposición cuasi-Favorskii" procede sin un nucleófilo adicional para formar el producto final contratado.
Contracciones catiónicas
La contracción del reordenamiento catiónico procede a través de la pérdida de un grupo saliente y la migración de un enlace endocíclico al carbocatión. Los reordenamientos de tipo pinacol se utilizan a menudo para este tipo de contracción. Al igual que la reacción de expansión, esto procede con un grupo donante de electrones que ayuda en la migración.
Las reacciones de contracción de un anillo se pueden combinar con la expansión de otro para dar una bicicleta desigual a partir de un anillo fusionado del mismo tamaño. Estos reordenamientos catiónicos se han utilizado para sintetizar los núcleos de moléculas complejas.
Contracciones carbenoides
El reordenamiento de Wolff se puede utilizar para realizar contracciones en anillo. Procede a través de un carbenoide generado a partir de la descomposición de una diazocetona, que se inserta en el enlace carbono-carbono en el lado opuesto de la cetona.
Referencias
- ^ Casadei, MA; Calli, C .; Mandolini, L. (1 de febrero de 1984). "Reacciones de cierre de anillo. 22. Cinética de ciclación de (.omega.-bromoalquil) malonatos de dietilo en el rango de anillos de 4 a 21 miembros. Papel de la deformación del anillo". Revista de la Sociedad Química Estadounidense . 106 (4): 1051–1056. doi : 10.1021 / ja00316a039 .
- ^ a b c Kantorowski, EJ; Kurth, MJ (2000). "Expansión a anillos de siete miembros" (PDF) . Tetraedro . 56 (26): 4317–4353. doi : 10.1016 / S0040-4020 (00) 00218-0 . S2CID 34628258 . Archivado desde el original (PDF) el 18 de agosto de 2019.
- ^ Kurti, L .; Czako, B. (2005). Aplicaciones estratégicas de reacciones nombradas . Elsevier. pag. 350. ISBN 978-0-12-429785-2 . OCLC 1107566236 .
- ^ Bieräugel, H .; Akkerman, JM; Armande, JCL; Pandit, Reino Unido (1974). "Una inserción específica de carbenos en enlaces carbono-carbono". Letras de tetraedro . 15 (33): 2817–2820. doi : 10.1016 / S0040-4039 (01) 91751-4 .
- ^ Hoberg, JO; Bozell, JJ (septiembre de 1995). "Ciclopropanación y expansión de anillo de azúcares insaturados". Letras de tetraedro . 36 (38): 6831–6834. doi : 10.1016 / 0040-4039 (95) 01387-W .
- ↑ Hierold, J .; Lupton, DW (julio de 2012). "Síntesis de γ-lactonas espirocíclicas por expansión / ciclación del anillo de Cascade Beckwith-Dowd". Letras orgánicas . 14 (13): 3412–3415. doi : 10.1021 / ol301387t . PMID 22691029 .
- ^ Dowd, P .; Choi; SCJ Am. Chem. Soc. 1987, 3493–3494
- ^ McMurry, John (2008). Química Orgánica 7ma Ed . págs. 945–946. ISBN 978-0-495-11258-7 .
- ^ Blanco, JD; Hrnciar, P .; Stappenbeck, F. (1999). "Síntesis total asimétrica de (+) - codeína mediante inserción de carbenoides intramolecular". Revista de Química Orgánica . 63 (21): 7871–7884. doi : 10.1021 / jo990905z .
- ^ Marchand, AP; Kumar, VS; Hariprakasha, HK (2001). "Síntesis de nuevos oxaheterociclos en jaula". Revista de Química Orgánica . 66 (6): 2072-2077. doi : 10.1021 / jo001611c . PMID 11300903 .
- ↑ Silva, LF Tetrahedron 2002, 9137–9161
- ^ a b Myers, Andrew. "Métodos para la contracción del anillo" (PDF) . Consultado el 30 de noviembre de 2014 , a través del Departamento de Química y Biología Química de la Universidad de Harvard.
- ^ Chenier, Philip J. (1978). "El reordenamiento de Favorskii en compuestos policíclicos puenteados". Revista de educación química . 55 (5): 286-291. Código bibliográfico : 1978JChEd..55..286C . doi : 10.1021 / ed055p286 .
- ^ Song, Zhen-Lei; Fan, Chun-An; Tu, Yong-Qiang (2011). "Reordenamiento de semipinacol en síntesis de productos naturales". Revisiones químicas . 111 (11): 7523–7556. doi : 10.1021 / cr200055g . PMID 21851053 .
- ^ Büchi, G .; Hofheinz, W .; Paukstelis, JV (noviembre de 1969). "Síntesis de (-) - aromadendreno y sesquiterpenos relacionados". Revista de la Sociedad Química Estadounidense . 91 (23): 6473–6478. doi : 10.1021 / ja01051a051 .
- ^ Kirmse, W. (julio de 2002). "100 años del reordenamiento de Wolff". Revista europea de química orgánica . 2002 (14): 2193. doi : 10.1002 / 1099-0690 (200207) 2002: 14 <2193 :: AID-EJOC2193> 3.0.CO; 2-D .