Anemia por deficiencia de vitamina B 12 -Vitamin B12 deficiency anemia
| Anemia por deficiencia de vitamina B 12 | |
|---|---|
| Otros nombres | Anemia perniciosa, anemia de Biermer, anemia de Addison, anemia de Addison-Biermer |
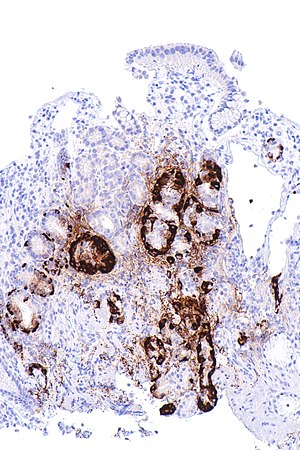 | |
| Micrografía que muestra hiperplasia de células nodulares tipo enterocromafina, como se demuestra con inmunotinción con cromogranina A , en el cuerpo del estómago . Las células parietales no son evidentes. Estos cambios están en consonancia con la gastritis atrófica metaplásica autoinmune, un correlato histológico de la anemia por deficiencia de vitamina B 12 . | |
| Especialidad | Hematología |
| Síntomas | Sensación de cansancio, dificultad para respirar , piel pálida, entumecimiento de manos y pies, reflejos deficientes , confusión. |
| Inicio habitual | > 60 años |
| Causas | Insuficiente vitamina B 12 |
| Método de diagnóstico | Análisis de sangre , análisis de médula ósea |
| Tratamiento | Pastillas o inyecciones de vitamina B 12 |
| Pronóstico | Con tratamiento una vida normal |
| Frecuencia | 1 por 1000 personas |
La anemia por deficiencia de vitamina B 12 , de la cual la anemia perniciosa ( AP ) es un tipo, es una enfermedad en la que no se producen suficientes glóbulos rojos debido a una deficiencia de vitamina B 12 . El síntoma inicial más común es sentir cansancio y debilidad . Otros síntomas pueden incluir dificultad para respirar , piel pálida, sensación de que se puede desmayar (aturdimiento), dolor en el pecho, latidos cardíacos rápidos , entumecimiento de manos y pies, falta de equilibrio, bajada frecuente de la presión arterial , pérdida de apetito, lengua roja, reflejos deficientes y, en casos graves, incluso depresión y confusión. Sin tratamiento, algunos de estos problemas pueden volverse permanentes.
La anemia perniciosa se refiere a la anemia que resulta de la falta de vitamina B12. La falta de factor intrínseco se debe más comúnmente a un ataque autoinmune a las células que lo crean en el estómago . También puede ocurrir después de la extirpación quirúrgica de parte del estómago o de un trastorno hereditario. Otras causas de niveles bajos de vitamina B 12 incluyen una ingesta dietética insuficiente (que puede ser un riesgo en una dieta vegana ), la enfermedad celíaca o la infección por tenia . Cuando se sospecha, el diagnóstico se realiza mediante análisis de sangre y, en ocasiones, de médula ósea. Los análisis de sangre pueden mostrar menos glóbulos rojos pero más grandes , una cantidad baja de glóbulos rojos jóvenes , niveles bajos de vitamina B 12 y anticuerpos contra el factor intrínseco.
La anemia perniciosa se puede tratar con inyecciones de vitamina B 12 . Si los síntomas son graves, por lo general se recomiendan inicialmente las inyecciones. Para aquellos que tienen problemas para tragar pastillas, hay un aerosol nasal disponible. A menudo, el tratamiento es de por vida.
La anemia perniciosa debida a problemas autoinmunitarios se presenta en aproximadamente una de cada 1000 personas. Entre los mayores de 60 años, aproximadamente el 2% padece la afección. Afecta más comúnmente a personas de ascendencia del norte de Europa. Las mujeres se ven afectadas con más frecuencia que los hombres. Con el tratamiento adecuado, la mayoría de las personas viven una vida normal. Debido al mayor riesgo de cáncer de estómago , las personas con anemia perniciosa deben someterse a controles periódicos para detectar esto. La primera descripción clara fue hecha por Thomas Addison en 1849. El término "pernicioso" significa "mortal", y este término entró en uso porque antes de la disponibilidad del tratamiento, la enfermedad a menudo era fatal.
Signos y síntomas
La progresión de la anemia perniciosa es lenta. Puede ser difícil reconocer los síntomas porque puede acostumbrarse a no sentirse bien. si no se trata, puede provocar complicaciones neurológicas y, en casos graves, la muerte. Muchos de los signos y síntomas se deben a la anemia en sí, cuando hay anemia. Los síntomas pueden incluir:
- sentirse cansado, débil constantemente (fatiga)
- mareos o sensación de desmayo (aturdimiento)
- manos y pies fríos
- malestar estomacal y náuseas
- una lengua roja dolorida ( glositis ), también llamada lengua de cereza
- latidos cardíacos rápidos (aleteo o latidos cardíacos irregulares)
- una caída frecuente de la presión arterial (hipotensión)
- una piel amarillenta y pálida ( ictericia )
- falta de aliento "los suspiros"
- bajo grado de fiebre , temblores y constante sensación de frío
- pérdida de apetito y pérdida de peso
- diarrea o estreñimiento
- Queilitis angular (lesiones inflamatorias en las comisuras de la boca)
- pérdida y debilidad del cabello, encanecimiento temprano del cabello
- dolor de pecho ( angina )
En casos más graves o prolongados de anemia perniciosa; puede provocar daño a los nervios, lo que causa complicaciones neurológicas, puede incluir:
- Sensaciones anormales que incluyen hormigueo o entumecimiento en los dedos de las manos y los pies ( hormigueo ), pérdida de sentido, dificultad en la propiocepción y dolor neuropático (la anemia por deficiencia de vitamina B 12 es la única anemia que afecta el sistema nervioso y el cerebro)
- Disminución de las capacidades mentales, que incluyen cambios de personalidad, depresión , irritabilidad , confusión, estupor , deterioro cognitivo (incluida la dificultad para concentrarse y respuestas lentas, conocidas coloquialmente como niebla mental ).
- cambios en la movilidad; incluyendo caminar inestable ( ataxia ), falta de equilibrio y pérdida de la sensibilidad en los pies
- visión borrosa (alterada)
- problemas de memoria
- debilidad muscular , dolor articular severo ( artralgia )
El síntoma inicial más común es sentir cansancio y debilidad (en general), aunque; La anemia puede presentarse con una serie de síntomas comunes adicionales, que incluyen úlceras en la boca, encías sangrantes, aspecto de agotamiento con labios pálidos y deshidratados o agrietados y círculos oscuros alrededor de los ojos, así como uñas quebradizas. Debido a que la AF afecta el sistema nervioso, lo que causa complicaciones neurológicas, los síntomas también pueden incluir pérdida y cambios en los reflejos, cambios de humor, tinnitus, dificultad para orinar, marcha inestable, problemas de fertilidad, ansiedad, psicosis y torpeza. Además, puede producirse una disminución del gusto o del olfato. La anemia también puede provocar soplos cardíacos, alteración de la presión arterial ( baja o alta ). La deficiencia también puede presentarse con trastornos de la tiroides. En casos severos, la anemia puede causar evidencia de insuficiencia cardíaca congestiva. Una complicación de la PA crónica grave es la degeneración subaguda combinada de la médula espinal , que conduce a pérdida sensorial distal (columna posterior), ausencia del reflejo del tobillo, aumento de la respuesta refleja de la rodilla y respuesta plantar extensora. Además de la anemia, los síntomas hematológicos pueden incluir citopenias , hemólisis intramedular y microangiopatía pseudotrombótica. La anemia perniciosa puede contribuir a un retraso en el crecimiento físico en los niños y también puede ser una causa de retraso en la pubertad para los adolescentes.
Causas
La vitamina B 12 no puede ser producida por el cuerpo humano y debe obtenerse de la dieta. Cuando se ingieren alimentos que contienen B 12 , la vitamina generalmente se une a las proteínas y es liberada por las proteasas liberadas por el páncreas en el intestino delgado. Después de su liberación, la mayor parte de la B 12 es absorbida por el cuerpo en el intestino delgado ( íleon ) después de unirse a una proteína conocida como factor intrínseco . El factor intrínseco es producido por las células parietales de la mucosa gástrica (revestimiento del estómago) y el complejo intrínseco del factor B 12 es absorbido por los receptores de cubilina en las células epiteliales del íleon . La PA se caracteriza por una deficiencia de B 12 causada por la ausencia de factor intrínseco.
La PA puede considerarse como una etapa final de la gastritis inmunitaria , una enfermedad caracterizada por atrofia del estómago y la presencia de anticuerpos contra las células parietales y el factor intrínseco. Una forma específica de gastritis crónica, la gastritis tipo A o la gastritis corporal atrófica, está altamente asociada con la AP. Este trastorno autoinmune se localiza en el cuerpo del estómago, donde se encuentran las células parietales. Los anticuerpos contra el factor intrínseco y las células parietales provocan la destrucción de la mucosa gástrica oxíntica, en la que se encuentran las células parietales, lo que conduce a la pérdida subsiguiente de la síntesis del factor intrínseco. Sin factor intrínseco, el íleon ya no puede absorber B 12 .
Aunque el papel exacto de la infección por Helicobacter pylori en la AP sigue siendo controvertido, la evidencia indica que H. pylori está involucrado en la patogenia de la enfermedad. Una infección prolongada por H. pylori puede causar autoinmunidad gástrica por un mecanismo conocido como mimetismo molecular . Los anticuerpos producidos por el sistema inmunológico pueden tener reactividad cruzada y pueden unirse tanto a los antígenos de H. pylori como a los que se encuentran en la mucosa gástrica . Los anticuerpos son producidos por células B activadas que reconocen tanto patógenos como péptidos auto-derivados. Los autoantígenos que se cree que causan la autorreactividad son las subunidades alfa y beta de la H + / K + -ATPasa. En un estudio, la deficiencia de B12 causada por Helicobacter pylori se correlacionó positivamente con la positividad de CagA y la actividad inflamatoria gástrica, en lugar de la atrofia gástrica.
Con menos frecuencia, H. pylori y el síndrome de Zollinger-Ellison también pueden causar una forma de gastritis no autoinmune que puede provocar anemia perniciosa.
La absorción deficiente de B 12 también puede ocurrir después de la extirpación gástrica ( gastrectomía ) o la cirugía de bypass gástrico. En estas cirugías, las partes del estómago que producen secreciones gástricas se eliminan o se omiten. Esto significa que el factor intrínseco, así como otros factores necesarios para la absorción de B 12 , no están disponibles. Sin embargo, la deficiencia de B 12 después de la cirugía gástrica no suele convertirse en un problema clínico. Esto probablemente se deba a que el cuerpo almacena B 12 durante muchos años en el hígado y los pacientes de cirugía gástrica reciben un suplemento adecuado de la vitamina.
Aunque no se han identificado genes específicos de susceptibilidad a PA, es probable que haya un factor genético involucrado en la enfermedad. La anemia perniciosa se encuentra a menudo junto con otros trastornos autoinmunitarios, lo que sugiere que los genes de susceptibilidad autoinmunitaria comunes pueden ser un factor causal. A pesar de eso, los estudios familiares previos y los informes de casos centrados en la AP han sugerido que existe una tendencia a la herencia genética de la AP en particular, y los familiares cercanos de los pacientes con AP parecen tener una mayor incidencia de AP y afecciones asociadas a la AP. Además, se indicó además que la formación de anticuerpos contra las células gástricas estaba determinada por un gen autosómico dominante, y la presencia de anticuerpos contra las células gástricas podría no estar necesariamente relacionada con la aparición de gastritis atrófica relacionada con la AP.
Fisiopatología
Aunque el cuerpo sano almacena de tres a cinco años de B 12 en el hígado, la actividad autoinmune generalmente no detectada en el intestino durante un período prolongado de tiempo conduce al agotamiento de B 12 y la anemia resultante. Las enzimas requieren B 12 para dos reacciones: la conversión de metilmalonil CoA en succinil CoA y la conversión de homocisteína en metionina . En la última reacción, el grupo metilo del 5-metiltetrahidrofolato se transfiere a la homocisteína para producir tetrahidrofolato y metionina. Esta reacción es catalizada por la enzima metionina sintasa con B 12 como cofactor esencial. Durante la deficiencia de B 12 , esta reacción no puede continuar, lo que conduce a la acumulación de 5-metiltetrahidrofolato. Esta acumulación agota los otros tipos de folato necesarios para la síntesis de purina y timidilato , que son necesarios para la síntesis de ADN. La inhibición de la replicación del ADN en los glóbulos rojos en maduración da como resultado la formación de eritrocitos megaloblásticos frágiles y grandes . Se cree que los aspectos neurológicos de la enfermedad surgen de la acumulación de metilmalonil CoA debido al requerimiento de B 12 como cofactor de la enzima metilmalonil CoA mutasa.
Diagnóstico

Se cree que la anemia perniciosa es principalmente un trastorno autoinmunitario que daña las células parietales del estómago, ya que provoca una disminución de la producción del factor intrínseco y una absorción deficiente de B- 12 ; Sin embargo, la anemia perniciosa también puede tener un componente genético , potencialmente hereditaria. Se puede sospechar anemia perniciosa cuando el frotis de sangre de un paciente muestra eritrocitos grandes, quebradizos e inmaduros, conocidos como megaloblastos . un diagnóstico de anemia perniciosa Requiere una prueba de hemograma y un frotis de sangre y estas pruebas incluyen:
- Hemograma completo y frotis de sangre periférica; La PA primero requiere la demostración de anemia megaloblástica mediante la realización de un hemograma completo y un frotis de sangre, que evalúa el volumen corpuscular medio (MCV), así como la concentración de hemoglobina corpuscular media (MCHC). La PA se identifica con un MCV alto ( anemia macrocítica ) y un MCHC normal (anemia normocrómica ). Los ovalocitos también se ven típicamente en el frotis de sangre, y unacaracterística patognomónica de las anemias megaloblásticas (que incluyen PA y otras) son los neutrófilos hipersegmentados.
- Vitamina B 12 en suero ; Los niveles séricos se utilizan para detectar su deficiencia, pero no distinguen sus causas. Losniveles devitamina B 12 pueden ser falsamente altos o bajos y los datos de sensibilidad y especificidad varían ampliamente. Se pueden encontrar niveles séricos normales en casos de deficiencia dondeestán presentes trastornos mieloproliferativos , enfermedad hepática ,deficiencia de transcobalamina II o sobrecrecimiento bacteriano intestinal .
- Anticuerpos de células parietales y factor intrínseco ; La sangre se analiza en busca de anticuerpos contra IF y células parietales en el estómago. La presencia de anticuerpos contra las células parietales gástricas y la IF es común en la AP. Los anticuerpos de células parietales se encuentran en otros trastornos autoinmunes y también en hasta un 10% de los individuos sanos. Sin embargo, alrededor del 85% de los pacientes con AP tienen anticuerpos de células parietales, lo que significa que son un marcador sensible de la enfermedad. Los anticuerpos de factor intrínseco son mucho menos sensibles que los anticuerpos de células parietales, pero son mucho más específicos. Se encuentran en aproximadamente la mitad de los pacientes con AP y muy raramente se encuentran en otros trastornos. Estas pruebas de anticuerpos pueden distinguir entre PA y malabsorción de B12 de alimentos .
- Ácido metilmalónico y / u homocisteína ; La vitamina B 12 juega un papel importante en los procesos metabólicos y las funciones celulares. Por tanto, su deficiencia conduce a la acumulación de algunos productos metabólicos. El ácido metilmalónico y / o la homocisteína es uno de los productos metabólicos que se pueden medir en la sangre. ya que el aumento en los niveles de ambos ayuda a diferenciar entre la deficiencia de vitamina B 12 y la deficiencia de ácido fólico , porque la homocisteína sola aumenta en esta última.
Se pueden encontrar niveles elevados de gastrina en alrededor del 80-90% de los casos de AP, pero también se pueden encontrar en otras formas de gastritis. También se pueden encontrar niveles disminuidos de pepsinógeno I o una proporción disminuida de pepsinógeno I a pepsinógeno II, aunque estos hallazgos son menos específicos de AP y pueden encontrarse en malabsorción de B 12 de alimentos y otras formas de gastritis.
El diagnóstico de gastritis atrófica tipo A debe confirmarse mediante gastroscopia y biopsia escalonada. Aproximadamente el 90% de las personas con PA tienen anticuerpos contra las células parietales; sin embargo, solo el 50% de todos los individuos de la población general con estos anticuerpos tienen anemia perniciosa.
En el diagnóstico diferencial de la anemia megaloblástica deben considerarse formas de deficiencia de vitamina B 12 distintas de la AP . Por ejemplo, un estado deficiente de B 12 que causa anemia megaloblástica y que puede confundirse con la AP clásica puede ser causado por una infección con la tenia Diphyllobothrium latum , posiblemente debido a la competencia del parásito con el huésped por la vitamina B 12 .
La prueba clásica para PA, la prueba de Schilling , ya no se usa ampliamente, ya que existen métodos más eficientes. Esta prueba histórica consistió, en su primer paso, en tomar una dosis oral de vitamina B 12 radiomarcada , seguida de la cuantificación de la vitamina en la orina del paciente durante un período de 24 horas mediante la medición de la radiactividad . Un segundo paso de la prueba repite el régimen y el procedimiento del primer paso, con la adición de factor intrínseco oral. Un paciente con PA presenta cantidades de factor intrínseco inferiores a las normales; por lo tanto, la adición de factor intrínseco en el segundo paso da como resultado un aumento en la absorción de vitamina B 12 (por encima de la línea de base establecida en el primero). La prueba de Schilling distinguió la PA de otras formas de deficiencia de B 12 , específicamente, del síndrome de Imerslund-Grasbeck (IGS), una deficiencia de vitamina B12 causada por mutaciones en cubilina, el receptor de cobalamina.
Tratamiento
El tratamiento de la AP varía según el país y la zona. Las opiniones varían sobre la eficacia de la administración (parenteral / oral), la cantidad y el intervalo de tiempo de las dosis o las formas de vitamina B 12 (por ejemplo, cianocobalamina / hidroxocobalamina). Aún se necesitan estudios más completos para validar la viabilidad de un método terapéutico particular para la AF en la práctica clínica. Falta una cura permanente para la AP, aunque se debe esperar que la reposición de B 12 resulte en el cese de los síntomas relacionados con la anemia, la detención del deterioro neurológico y, en los casos en que los problemas neurológicos no están avanzados, la recuperación neurológica y la remisión completa y permanente. de todos los síntomas, siempre que se complemente con B 12 . La reposición de B 12 se puede lograr de diversas formas.
Inyecciones intramusculares
El tratamiento estándar para la PA ha sido inyecciones intramusculares de cobalamina en forma de cianocobalamina (CN-Cbl), hidroxocobalamina (OH-Cbl) o metilcobalamina .
Dosis orales
El tratamiento con dosis altas de vitamina B 12 1000 mcg (1 mg) en forma oral también parece tan eficaz y más económico que la forma parenteral.
Pronóstico
Una persona con AF bien tratada puede llevar una vida saludable. Sin embargo, no diagnosticar y tratar a tiempo puede resultar en daño neurológico permanente, fatiga excesiva, depresión, pérdida de memoria y otras complicaciones. En casos graves, las complicaciones neurológicas de la anemia perniciosa pueden provocar la muerte, de ahí el nombre " pernicioso ", que significa mortal.
Se ha observado una asociación entre la anemia perniciosa y ciertos tipos de cáncer gástrico, pero no se ha establecido una relación causal.
Epidemiología
Se estima que la AP afecta al 0,1% de la población general y al 1,9% de los mayores de 60 años, lo que representa del 20 al 50% de la deficiencia de B 12 en los adultos. Una revisión de la literatura muestra que la prevalencia de AP es más alta en el norte de Europa, especialmente en los países escandinavos, y entre las personas de ascendencia africana, y que una mayor conciencia de la enfermedad y mejores herramientas de diagnóstico podrían desempeñar un papel en las tasas de incidencia aparentemente más altas.
Historia
Los síntomas fueron descritos por primera vez en 1822 por el Dr. James Scarth Combe en las Transacciones de la Sociedad Médico-Quirúrgica de Edimburgo , bajo el título de Historia de un caso de anemia .
Sin embargo, esto no fue investigado con más profundidad hasta 1849, por el médico británico Thomas Addison , de quien adquirió el nombre común de anemia de Addison. En 1871, el médico alemán Michael Anton Biermer (1827-1892) notó la característica particular de la anemia en uno de sus pacientes; más tarde acuñó el término "anemia perniciosa progresiva". En 1907, Richard Clarke Cabot informó sobre una serie de 1200 pacientes con AP; su supervivencia media fue de entre uno y tres años. William Bosworth Castle realizó un experimento en el que ingirió carne cruda de hamburguesa y la regurgitó después de una hora, y posteriormente se la dio a un grupo de 10 pacientes. Se alimentó al grupo de control con carne de hamburguesa cruda sin tratar. El primer grupo mostró una respuesta a la enfermedad, mientras que el segundo grupo no. Esta no era una práctica sostenible, pero demostró la existencia de un 'factor intrínseco' del jugo gástrico.
La anemia perniciosa era una enfermedad mortal antes del año 1920, cuando George Whipple sugirió el hígado crudo como tratamiento. El primer tratamiento viable para la anemia perniciosa comenzó cuando Whipple hizo un descubrimiento en el curso de experimentos en los que sangró a los perros para hacerlos anémicos, luego los alimentó con varios alimentos para ver cuál los haría recuperarse más rápidamente (estaba buscando tratamientos para la anemia). por sangrado, no por anemia perniciosa). Whipple descubrió que la ingestión de grandes cantidades de hígado parecía curar la anemia por pérdida de sangre, y probó la ingestión del hígado como tratamiento para la anemia perniciosa, informando también una mejoría allí en un artículo de 1920. George Minot y William Murphy se dispusieron entonces a aislar parcialmente la enfermedad. propiedad curativa en el hígado, y en 1926 demostró que estaba contenido en jugo de hígado crudo (en el proceso también mostró que era el hierro en el tejido hepático, no el factor soluble en el jugo de hígado, lo que curaba la anemia por hemorragia en perros); por tanto, el descubrimiento del factor jugo del hígado como tratamiento para la anemia perniciosa había sido una coincidencia. Frieda Robscheit-Robbins trabajó en estrecha colaboración con Whipple, coautor de 21 artículos entre 1925 y 1930. Para el descubrimiento de la cura de una enfermedad previamente mortal de causa desconocida, Whipple, Minot y Murphy compartieron el Premio Nobel de Medicina de 1934 .
Después de la verificación de Minot y Murphy de los resultados de Whipple en 1926, las víctimas de anemia perniciosa comieron o bebieron al menos media libra de hígado crudo, o bebieron jugo de hígado crudo, todos los días. Esto continuó durante varios años, hasta que estuvo disponible un concentrado de jugo de hígado. En 1928, el químico Edwin Cohn preparó un extracto de hígado que era de 50 a 100 veces más potente que el alimento natural (hígado). El extracto incluso podría inyectarse en el músculo, lo que significaba que los pacientes ya no necesitaban comer grandes cantidades de hígado o jugo. Esto también redujo considerablemente el costo del tratamiento.
El ingrediente activo en el hígado permaneció desconocido hasta 1948, cuando fue aislado por dos químicos, Karl A. Folkers de los Estados Unidos y Alexander R. Todd de Gran Bretaña. La sustancia era una cobalamina , que los descubridores llamaron vitamina B 12 . La nueva vitamina en el jugo de hígado finalmente se purificó y caracterizó por completo en la década de 1950, y se desarrollaron otros métodos para producirla a partir de bacterias. Podría inyectarse en el músculo con incluso menos irritación, lo que hace posible tratar la PA con aún más facilidad. La anemia perniciosa finalmente se trató con inyecciones o grandes dosis orales de B 12 , típicamente entre 1 y 4 mg al día.
Un escritor ha planteado la hipótesis de que Mary Todd Lincoln , la esposa del presidente estadounidense Abraham Lincoln , tuvo una anemia perniciosa durante décadas y murió a causa de ella.
Investigar
Complejo SNAC
Aunque las megadosis orales y las inyecciones intramusculares son los métodos de tratamiento más comunes disponibles en la actualidad, se están probando varios métodos novedosos, que son muy prometedores para su futura incorporación a los métodos de tratamiento convencionales. Como las inyecciones son vehículos desfavorables para la administración de fármacos, la investigación actual implica mejorar la difusión pasiva a través del íleon tras la ingestión oral de derivados de cobalamina. Los investigadores han aprovechado recientemente el nuevo compuesto N- [8- (2-hidroxibenzoil) amino] caprilato de sodio (SNAC), que mejora en gran medida tanto la biodisponibilidad como la estabilidad metabólica. SNAC puede formar un complejo no covalente con cobalamina mientras conserva su integridad química. Este complejo es mucho más lipofílico que la vitamina B 12 soluble en agua , por lo que es capaz de atravesar las membranas celulares con mayor facilidad.
Factor intrínseco recombinante
Otro método para aumentar la absorción a través del íleon es ingerir un complejo Cbl al que ya está unido IF. La falta de factor intrínseco producido por el cuerpo del paciente se puede complementar utilizando IF humana sintética producida a partir de recombinantes de plantas de guisantes . Sin embargo, en los casos en los que los anticuerpos IF son la causa de la malabsorción a través del íleon, este tratamiento sería ineficaz.
Entrega sublingual
También se ha postulado que los tratamientos sublinguales son más efectivos que los tratamientos orales solos. Un estudio de 2003 encontró que, si bien este método es efectivo, una dosis de 500 μg de cianocobalamina administrada por vía oral o sublingual es igualmente eficaz para restaurar las concentraciones fisiológicas normales de cobalamina.
Referencias
enlaces externos
| Clasificación | |
|---|---|
| Recursos externos |

