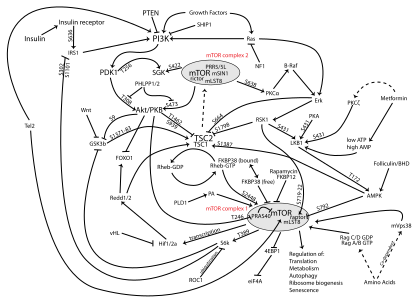
Vía PI3K / AKT / mTOR - PI3K/AKT/mTOR pathway
La vía PI3K / AKT / mTOR es una vía de señalización intracelular importante en la regulación del ciclo celular . Por lo tanto, está directamente relacionado con la inactividad celular , la proliferación , el cáncer y la longevidad. La activación de PI3K fosforila y activa AKT , localizándolo en la membrana plasmática . AKT puede tener varios efectos posteriores, como activar CREB , inhibir p27 , localizar FOXO en el citoplasma, activar PtdIns -3ps y activar mTOR que puede afectar la transcripción de p70 o 4EBP1. Hay muchos factores conocidos que mejoran la vía PI3K / AKT, incluidos EGF , shh , IGF-1 , insulina y CaM. Tanto la leptina como la insulina reclutan la señalización de PI3K para la regulación metabólica. La vía es antagonizada por varios factores, incluidos PTEN , GSK3B y HB9.
En muchos cánceres, esta vía es hiperactiva, lo que reduce la apoptosis y permite la proliferación. Sin embargo, esta vía es necesaria para promover el crecimiento y la proliferación sobre la diferenciación de las células madre adultas , específicamente las células madre neurales . Es la dificultad de encontrar una cantidad apropiada de proliferación versus diferenciación lo que los investigadores están tratando de determinar para utilizar este equilibrio en el desarrollo de diversas terapias. Además, se ha descubierto que esta vía es un componente necesario en la potenciación neuronal a largo plazo .
Proliferación de células madre neurales.
Respuesta a la glucosa
Las células madre neurales (NSC) en el cerebro deben encontrar un equilibrio entre mantener su multipotencia mediante la renovación y la proliferación propia en lugar de diferenciarse y volverse inactivas. La vía PI3K / AKT es crucial en este proceso de toma de decisiones. Las NSC pueden detectar y responder a cambios en el cerebro o en todo el organismo. Cuando los niveles de glucosa en sangre se elevan de forma aguda, el páncreas libera insulina. La activación de los receptores de insulina activa la vía PI3K / AKT, que promueve la proliferación. De esta forma, cuando hay mucha glucosa y abundante energía en el organismo, se activa la vía PI3K / AKT y las NSC tienden a proliferar. Cuando hay bajas cantidades de energía disponible, la vía PI3K / AKT es menos activa y las células adoptan un estado inactivo. Esto ocurre, en parte, cuando AKT fosforila FOXO, manteniendo FOXO en el citoplasma. FOXO, cuando se desfosforila, puede ingresar al núcleo y funcionar como un factor de transcripción para promover la expresión de varios supresores de tumores como p27 y p21 . Estos supresores de tumores empujan al NSC a entrar en reposo. Los knockouts de FOXO pierden la capacidad de que las células entren en un estado inactivo, así como las células pierden su carácter de células madre neurales, posiblemente entrando en un estado similar al cáncer.
PTEN
La vía PI3K / AKT tiene un inhibidor natural llamado PTEN cuya función es limitar la proliferación en las células, ayudando a prevenir el cáncer. Se ha demostrado que la eliminación de PTEN aumenta la masa del cerebro debido a la proliferación no regulada que se produce. PTEN actúa desfosforilando PIP3 a PIP2, lo que limita la capacidad de los AKT para unirse a la membrana, disminuyendo su actividad. Las deficiencias de PTEN se pueden compensar aguas abajo para rescatar la diferenciación o la inactividad. Noquear a PTEN no es tan serio como noquear a FOXO por esta razón.
CREB
El elemento de respuesta de AMPc CREB está estrechamente relacionado con la decisión de la célula de proliferar o no. Las células que se ven obligadas a sobreexpresar AKT aumentan la cantidad de CREB y la proliferación en comparación con las células de tipo salvaje. Estas células también expresan menos marcadores de células gliales y neurales como GFAP o β-tubulina . Esto se debe a que CREB es un factor de transcripción que influye en la transcripción de ciclina A que promueve la proliferación. Por ejemplo, las células progenitoras neurales del hipocampo adultas necesitan estar en suspenso como células madre para diferenciarse más tarde. Esto está regulado por Shh . Shh actúa a través de una dependencia lenta de la síntesis de proteínas, que estimula otras cascadas que funcionan sinérgicamente con la vía PI3K / AKT para inducir la proliferación. Entonces, la otra vía puede desactivarse y los efectos de la vía PI3K / AKT se vuelven insuficientes para detener la diferenciación. Se desconocen los detalles de esta vía.
Funciones en el cáncer
En cáncer de ovario
La vía PI3K / AKT / mTOR es un regulador central del cáncer de ovario . Las quinasas PIM se expresan en exceso en muchos tipos de cánceres y también contribuyen a la regulación del cáncer de ovario . Se encuentra directa e indirectamente que PIM activa mTOR y sus efectores ascendentes como AKT. Además, las quinasas PIM pueden causar fosforilación de IRS, lo que puede alterar PI3K . Esto indica la estrecha interacción de PIM con la cascada PI3K / AKT / mTOR y sus componentes. De manera similar, también se ha informado que AKT realiza la fosforilación BAD en células OC. PIM y la red PI3K / AKT / mTOR pueden inhibir las expresiones P21 y P27 en las células OC. Estos datos sugieren una gran posibilidad de interacción y relevancia de las quinasas PIM y la red PI3K / AKT / mTOR en la regulación del cáncer de ovario. Sin embargo, apuntar a esta vía en el cáncer de ovario ha sido un desafío con varios ensayos que no lograron un beneficio clínico suficiente.
En cáncer de mama
En muchos tipos de cáncer de mama, las aberraciones en la vía PI3K / AKT / mTOR son las anomalías genómicas más comunes. Las aberraciones conocidas más comunes incluyen la mutación del gen PIK3CA y las mutaciones de pérdida de función o silenciamiento epigenético del homólogo de fosfatasa y tensina (PTEN). La vía fosfoinositido 3-quinasa (PI3K) / proteína quinasa B (Akt) / diana de la rapamicina en mamíferos (mTOR) se activa en aproximadamente 30 a 40% de los casos de BC. En TNBC , la activación oncogénica de la vía PI3K / AKT / mTOR puede ocurrir como una función de la sobreexpresión de reguladores aguas arriba como EGFR , mutaciones de activación de PIK3CA , pérdida de función o expresión de fosfatasa y homólogo de tensina (PTEN), y la proteína rica en prolina. inositol polifosfatasa, que son reguladores a la baja de PI3K. Es consistente con la hipótesis de que los inhibidores de PI3K pueden vencer la resistencia a la terapia endocrina cuando se adquiere
En cáncer urotelial
PIK3CA con frecuencia tiene mutaciones de ganancia de función en el cáncer urotelial. Al igual que PI3Ka, PI3Kb se expresa en muchas células diferentes y participa principalmente en la activación de plaquetas y el desarrollo de enfermedades trombóticas. Los estudios han demostrado que PI3Kb también contribuye a la proliferación de tumores. Específicamente, tiene un papel importante en la tumorigénesis en cánceres negativos a PTEN . Se informa que la interferencia con el gen de PI3Kb podría ser un enfoque terapéutico para los cánceres de vejiga de alto riesgo con PTEN mutante y pérdida de E-cadherina . Los inhibidores de isoformas específicos de PI3Kb son un tratamiento potencial para los cánceres deficientes en PTEN.
En cáncer de próstata
La vía PI3K es una fuente importante de resistencia a los medicamentos en el cáncer de próstata . Esto es particularmente cierto en el caso del cáncer de próstata resistente a la castración, donde los tumores se vuelven resistentes a la terapia de privación de andrógenos , que bloquea la capacidad de los tumores de utilizar la hormona andrógeno para crecer. Esto se debe a un complejo mecanismo de retroalimentación que existe entre el receptor de andrógenos y la vía PI3K. Al igual que en otros tipos de tumores, las mutaciones en genes clave de esta vía pueden conducir a la hiperactivación de esta vía, por ejemplo en PIK3CA. Los aumentos en el número de copias de PIK3CA y el aumento de la expresión de ARNm también aumentan la activación de la vía en cánceres de próstata, entre otros. Se ha demostrado que las ganancias en la región genética cercana 3q26.31-32 coexisten con varios miembros cercanos de la familia PI3K, incluidos PIK3CA , PIK3CB y PIK3R4 , lo que lleva a cambios transcripcionales en PIK3C2G , PIK3CA, PIK3CB, PIK3R4 , así como en las vías asociadas. con proliferación celular . Estas grandes ganancias de extensión se asocian con el grado de Gleason , el estadio del tumor , la metástasis en los ganglios linfáticos y otras características clínicas agresivas. En los pacientes tratados con inhibidores de PI3K, aquellos con aumentos en el número de copias en PIK3CB parecen tener una mayor susceptibilidad al fármaco.
Terapias
Inhibidor de PI3K
Los inhibidores de PI3K pueden superar la resistencia a los medicamentos y mejorar los resultados del cáncer de mama avanzado (ABC). Los diferentes inhibidores de PI3K exhiben un efecto diferente contra varios tipos de PI3K. Los inhibidores de pan-PI3K de clase IA se han estudiado más extensamente que los inhibidores específicos de isoformas; Pictilisib es otro inhibidor de pan-PI3K con mayor actividad inhibidora de subunidades α que buparlisib. Idelalisib es el primer inhibidor de PI3K aprobado por la Administración de Drogas y Alimentos de los EE. UU. Y se utiliza en el tratamiento de la leucemia linfocítica crónica recidivante / refractaria / linfoma de linfocitos pequeños y linfoma folicular. El copanlisib está aprobado para el linfoma folicular recidivante en pacientes que han recibido al menos dos terapias sistémicas previas. Duvelisib está aprobado para la leucemia linfocítica crónica / linfoma linfocítico pequeño (CLL / SLL) recidivante / refractario y el linfoma folicular recidivante / refractario, ambas indicaciones para pacientes que han recibido al menos dos tratamientos previos.
Inhibidor de Akt
AKT está aguas abajo de PI3K y es inhibida por Ipatasertib. Akt es una quinasa de la familia AGC y un nodo de señalización integral central de la vía PAM . Hay tres isoenzimas Akt, Akt1, Akt2 y Akt3. Los inhibidores de molécula pequeña de Akt1 podrían ser especialmente útiles para atacar tumores con una alta prevalencia de mutaciones activadoras de Akt1 E17K, que se observa en 4 a 6% de los cánceres de mama y 1 a 2% de cáncer colorrectal. La investigación hacia la inhibición de Akt se ha centrado en la inhibición de dos sitios de unión distintos: (1) el bolsillo alostérico de la enzima inactiva y (2) el sitio de unión de ATP. Los inhibidores alostéricos de Akt, destacados por MK-2206, se han evaluado extensamente en un entorno clínico; Recientemente, se han identificado inhibidores de Akt alostéricos adicionales. ARQ-092, es un potente inhibidor de pan-Akt que puede inhibir preclínicamente el crecimiento tumoral y actualmente se encuentra en estudios clínicos de fase I.
inhibidor de mTOR
Existe una correlación significativa de mTOR fosforilado con la tasa de supervivencia para pacientes con TNBC en estadios I y II . Un modelo de TNBC de xenoinjerto derivado del paciente que probaba el inhibidor de mTOR rapamicina mostró una inhibición del crecimiento tumoral del 77 al 99%, que es significativamente más de lo que se ha observado con la doxorrubicina; Los estudios de fosforilación de proteínas indicaron que la activación constitutiva de la vía mTOR disminuyó con el tratamiento.
Inhibidores duales de PI3K / AKT / mTOR
Se ha planteado la hipótesis de que el bloqueo de la vía PI3K / AKT / mTOR puede conducir a un aumento de la actividad antitumoral en TNBC . Los datos preclínicos han demostrado que la combinación de compuestos que se dirigen a diferentes moléculas afines en la vía PI3K / AKT / mTOR conduce a una actividad sinérgica. Sobre la base de estos hallazgos, continúan desarrollándose simultáneamente nuevos compuestos dirigidos a diferentes componentes de la vía PI3K / AKT / mTOR. Por ejemplo, gedatolisib inhibe las formas mutantes de PI3K-α con actividad quinasa elevada a concentraciones equivalentes a la CI50 para PI3K-α de tipo salvaje. Las isoformas de PI3K-β, -δ y -γ fueron inhibidas por gedatolisib en concentraciones aproximadamente 10 veces más altas que las observadas para PI3K-α. Otra ventaja de dirigirse simultáneamente a PI3K y mTOR es la consiguiente inhibición más robusta de los bucles de retroalimentación positivos de tirosina quinasa del receptor que se observan con la inhibición de PI3K aislada . Gedatolisib se encuentra actualmente en desarrollo para el tratamiento de TNBC, en combinación con el conjugado de fármaco-anticuerpo PTK7. Apitolisib (GDC-0980) es un inhibidor de PI3K (subunidades α, δ y γ) que también se dirige a mTORC
Terapia co-dirigida de la vía PI3K
Existen numerosas vías de señalización celular que presentan interferencia con la vía PI3K, lo que potencialmente permite que las células cancerosas escapen de la inhibición de PI3K. Como tal, la inhibición de la vía PI3K junto con otros objetivos podría ofrecer una respuesta sinérgica, como la que se observa con la inhibición co-dirigida a PI3K y MEK en células de cáncer de pulmón. Más recientemente, se ha sugerido el co-direccionamiento de la vía PI3K con las quinasas PIM, con numerosos estudios preclínicos que sugieren el beneficio potencial de este enfoque. El desarrollo de paneles de líneas celulares que son resistentes a la inhibición de la vía de PI3K puede conducir a la identificación de futuros co-objetivos y a una mejor comprensión de qué vías pueden compensar la pérdida de señalización de PI3K después del tratamiento farmacológico. La inhibición combinada de PI3K con terapias más tradicionales como la quimioterapia también puede ofrecer una respuesta mejorada sobre la inhibición de PI3K sola.
Células madre neurales
El tipo de señalización del factor de crecimiento puede afectar si las NSC se diferencian o no en neuronas motoras. Cebar un medio con FGF2 reduce la actividad de la vía PI3K / AKT, que activa GSK3β. Esto aumenta la expresión de HB9. La inhibición directa de PI3K en NSC conduce a una población de células que son puramente HB9 + y se diferencian con una eficacia elevada en neuronas motoras. El injerto de estas células en diferentes partes de ratas genera neuronas motoras independientemente del microambiente de las células trasplantadas. Después de la lesión, las células madre neurales entran en una fase de reparación y expresan altos niveles de PI3K para mejorar la proliferación. Esto es mejor para la supervivencia de las neuronas en su conjunto, pero a expensas de generar neuronas motoras. Por lo tanto, puede ser difícil para las neuronas motoras lesionadas recuperar su capacidad. El propósito de la investigación moderna es generar células madre neurales que puedan proliferar pero aún así diferenciarse en neuronas motoras. Reducir el efecto de la vía PI3K y aumentar el efecto de GSK3β y HB9 en las NSC es una forma potencial de generar estas células.
Inhibidores de PTEN
PTEN es un supresor de tumores que inhibe la vía PI3K / AKT. Los inhibidores de PTEN, como el bisperoxovanadio, pueden mejorar la vía PI3K / AKT para promover la migración, supervivencia y proliferación celular. Si bien existen algunas preocupaciones sobre la posible desregulación del ciclo celular y la tumorigénesis, la inhibición temporal y moderada de PTEN puede conferir neuroprotección contra la lesión cerebral traumática y mejorar la recuperación del SNC al restablecer las conexiones perdidas por axonogénesis . Queda por determinar el valor medicinal de los inhibidores de PTEN.
La potenciación a largo plazo
Para que ocurra la potenciación a largo plazo (LTP), debe haber estimulación de los receptores NMDA , lo que hace que los receptores AMPA se inserten postsinápticamente . PI3K se une a los receptores AMPA en una región conservada para orientar los receptores en la membrana, específicamente en la subunidad GluR. La actividad de PI3K aumenta en respuesta a los iones de calcio y CaM . Además, AKT localiza PtdIns-3P en la post sinapsis, que recluta proteínas de acoplamiento como tSNARE y Vam7. Esto conduce directamente al acoplamiento de AMPA en la post sinapsis. mTOR activó p70S6K e inactivó 4EBP1 que cambia la expresión génica para permitir que ocurra la LTP. El entrenamiento de acondicionamiento del miedo a largo plazo se vio afectado en ratas, pero no hubo ningún efecto en el acondicionamiento a corto plazo. Específicamente, se perdió el condicionamiento del miedo de la amígdala. Este es un tipo de condicionamiento de trazas que es una forma de aprendizaje que requiere la asociación de un estímulo condicionado con un estímulo incondicionado. Este efecto se perdió en las caídas de PI3K y aumentó en las sobreexpresiones de PI3K.
Papel en el crecimiento del cerebro
Además de su papel en la plasticidad sináptica descrita anteriormente, la vía de señalización de PI3K-AKT también tiene un papel importante en el crecimiento del cerebro, que se altera cuando se altera la señalización de PI3K. Por ejemplo, el volumen intracraneal también está asociado con esta vía, en particular con las variantes intrónicas de AKT3 . La hormona tiroidea se identificó originalmente como el regulador principal del crecimiento y la cognición del cerebro, y la evidencia reciente ha demostrado que la hormona tiroidea produce algunos de sus efectos sobre la maduración y plasticidad de las sinapsis a través de PI3K.