Unión neuromuscular - Neuromuscular junction
| Unión neuromuscular | |
|---|---|
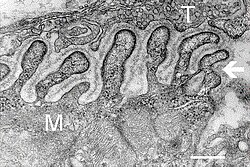
Micrografía electrónica que muestra una sección transversal a través de la unión neuromuscular. T es el axón terminal, M es la fibra muscular. La flecha muestra pliegues de unión con lámina basal . Las zonas activas son visibles en las puntas entre los pliegues. La escala es de 0,3 μm. Fuente: NIMH
| |
 Vista detallada de una unión neuromuscular:
| |
| Detalles | |
| Identificadores | |
| latín | sinapsis neuromuscularis; junctio neuromuscularis |
| Malla | D009469 |
| TH | H2.00.06.1.02001 |
| FMA | 61803 |
| Terminología anatómica | |

Una unión neuromuscular (o unión mioneural ) es una sinapsis química entre una neurona motora y una fibra muscular .
Permite que la neurona motora transmita una señal a la fibra muscular, provocando la contracción muscular .
Los músculos requieren inervación para funcionar, e incluso solo para mantener el tono muscular , evitando la atrofia . En el sistema neuromuscular, los nervios del sistema nervioso central y el sistema nervioso periférico están conectados y trabajan junto con los músculos. La transmisión sináptica en la unión neuromuscular comienza cuando un potencial de acción alcanza la terminal presináptica de una neurona motora, que activa los canales de calcio activados por voltaje para permitir que los iones de calcio entren en la neurona. Los iones de calcio se unen a las proteínas sensoras ( sinaptotagmina ) en las vesículas sinápticas, lo que desencadena la fusión de las vesículas con la membrana celular y la posterior liberación de neurotransmisores desde la neurona motora hacia la hendidura sináptica . En los vertebrados , las neuronas motoras liberan acetilcolina (ACh), un neurotransmisor de molécula pequeña, que se difunde a través de la hendidura sináptica y se une a los receptores nicotínicos de acetilcolina (nAChR) en la membrana celular de la fibra muscular, también conocida como sarcolema . nAChR son ionotrópicos receptores, lo que significa que sirven como ligando -gated canales iónicos . La unión de ACh al receptor puede despolarizar la fibra muscular, provocando una cascada que eventualmente resulta en la contracción muscular.
Las enfermedades de la unión neuromuscular pueden ser de origen genético y autoinmune . Los trastornos genéticos, como la distrofia muscular de Duchenne , pueden surgir de proteínas estructurales mutadas que comprenden la unión neuromuscular, mientras que las enfermedades autoinmunes, como la miastenia grave , ocurren cuando se producen anticuerpos contra los receptores nicotínicos de acetilcolina en el sarcolema.
Estructura y función
Transmisión cuántica
En la unión neuromuscular, los axones motores presinápticos terminan a 30 nanómetros de la membrana celular o sarcolema de una fibra muscular. El sarcolema en la unión tiene invaginaciones llamadas pliegues postuncionales, que aumentan su área de superficie frente a la hendidura sináptica. Estos pliegues postsinápticos forman la placa motora terminal, que está tachonada con receptores nicotínicos de acetilcolina (nAChR) a una densidad de 10.000 receptores / micrómetro 2 . Los axones presinápticos terminan en protuberancias llamadas botones terminales (o terminales presinápticas) que se proyectan hacia los pliegues postsinápticos del sarcolema. En la rana, cada terminal del nervio motor contiene unas 300.000 vesículas , con un diámetro medio de 0,05 micrómetros. Las vesículas contienen acetilcolina. Algunas de estas vesículas se agrupan en grupos de cincuenta, colocadas en zonas activas cercanas a la membrana nerviosa. Las zonas activas están separadas por aproximadamente 1 micrómetro. La hendidura de 30 nanómetros entre la terminación nerviosa y la placa terminal contiene una red de acetilcolinesterasa (AChE) a una densidad de 2600 moléculas de enzima / micrómetro 2 , mantenida en su lugar por las proteínas estructurales distrofina y rapsina . También está presente la proteína receptora tirosina quinasa MuSK , una proteína de señalización involucrada en el desarrollo de la unión neuromuscular, que también es mantenida en su lugar por rapsyn.
Aproximadamente una vez por segundo, en una unión en reposo, al azar, una de las vesículas sinápticas se fusiona con la membrana celular de la neurona presináptica en un proceso mediado por proteínas SNARE . La fusión da como resultado el vaciado del contenido de la vesícula de 7 000 a 10 000 moléculas de acetilcolina en la hendidura sináptica , un proceso conocido como exocitosis . En consecuencia, la exocitosis libera acetilcolina en paquetes que se denominan cuantos. El cuanto de acetilcolina se difunde a través de la red de acetilcolinesterasa, donde la alta concentración de transmisor local ocupa todos los sitios de unión de la enzima en su camino. La acetilcolina que llega a la placa terminal activa ~ 2000 receptores de acetilcolina, abriendo sus canales iónicos, lo que permite que los iones de sodio se muevan hacia la placa terminal produciendo una despolarización de ~ 0,5 mV conocida como potencial de placa terminal en miniatura (MEPP). En el momento en que la acetilcolina se libera de los receptores, la acetilcolinesterasa ha destruido su ACh unida, lo que tarda alrededor de 0,16 ms y, por lo tanto, está disponible para destruir la ACh liberada de los receptores.
Cuando se estimula el nervio motor hay un retraso de sólo 0,5 a 0,8 ms entre la llegada del impulso nervioso a las terminales nerviosas motoras y la primera respuesta de la placa terminal La llegada del potencial de acción del nervio motor a la terminal neuronal presináptica abre el voltaje los canales de calcio dependientes y los iones de Ca 2+ fluyen desde el líquido extracelular hacia el citosol de la neurona presináptica . Este influjo de Ca 2+ hace que varios cientos de vesículas que contienen neurotransmisores se fusionen con la membrana celular de la neurona presináptica a través de proteínas SNARE para liberar sus cuantos de acetilcolina por exocitosis. La despolarización de la placa terminal por la acetilcolina liberada se denomina potencial de placa terminal (EPP). El EPP se logra cuando la ACh se une a los receptores nicotínicos de acetilcolina (nAChR) en la placa motora terminal y provoca un influjo de iones de sodio. Esta afluencia de iones de sodio genera el EPP (despolarización) y desencadena un potencial de acción que viaja a lo largo del sarcolema y hacia la fibra muscular a través de los túbulos T (túbulos transversales) por medio de canales de sodio activados por voltaje. La conducción de potenciales de acción a lo largo de los túbulos T estimula la apertura de canales de Ca 2+ dependientes de voltaje que están acoplados mecánicamente a canales de liberación de Ca 2+ en el retículo sarcoplásmico. El Ca 2+ luego se difunde fuera del retículo sarcoplásmico a las miofibrillas para que pueda estimular la contracción. El potencial de la placa terminal es, por tanto, responsable de establecer un potencial de acción en la fibra muscular que desencadena la contracción muscular. La transmisión del nervio al músculo es tan rápida porque cada cuanto de acetilcolina llega a la placa terminal en concentraciones milimolares, lo suficientemente altas como para combinarse con un receptor de baja afinidad, que luego libera rápidamente el transmisor unido.
Receptores de acetilcolina

- Receptor ligado al canal de iones
- Iones
- Ligando (como acetilcolina )
La acetilcolina es un neurotransmisor sintetizado a partir de la colina dietética y la acetil-CoA (ACoA), y participa en la estimulación del tejido muscular en vertebrados y en algunos animales invertebrados . En los vertebrados, el subtipo de receptor de acetilcolina que se encuentra en la unión neuromuscular de los músculos esqueléticos es el receptor nicotínico de acetilcolina (nAChR), que es un canal iónico controlado por ligando . Cada subunidad de este receptor tiene un "cys-loop" característico, que está compuesto por un residuo de cisteína seguido de 13 residuos de aminoácidos y otro residuo de cisteína. Los dos residuos de cisteína forman un enlace disulfuro que da como resultado el receptor "cys-loop" que es capaz de unirse a acetilcolina y otros ligandos. Estos receptores cys-loop se encuentran solo en eucariotas , pero los procariotas poseen receptores ACh con propiedades similares. No todas las especies utilizan una unión neuromuscular colinérgica ; por ejemplo, los cangrejos de río y las moscas de la fruta tienen una unión neuromuscular glutamatérgica .
Los AChR en la unión neuromuscular esquelética forman heteropentámeros compuestos por dos subunidades α, una β, una ɛ y una δ. Cuando un único ligando de ACh se une a una de las subunidades α del receptor de ACh, induce un cambio conformacional en la interfaz con la segunda subunidad α de AChR. Este cambio conformacional da como resultado una mayor afinidad de la segunda subunidad α por un segundo ligando de ACh. Los AChR, por lo tanto, exhiben una curva de disociación sigmoidea debido a esta unión cooperativa . La presencia de la estructura del receptor intermedio inactivo con un ligando de unión simple mantiene la ACh en la sinapsis que de otro modo podría perderse por hidrólisis o difusión de la colinesterasa . La persistencia de estos ligandos de ACh en la sinapsis puede provocar una respuesta postsináptica prolongada.
Desarrollo
El desarrollo de la unión neuromuscular requiere la señalización tanto de la terminal de la neurona motora como de la región central de la célula muscular. Durante el desarrollo, las células musculares producen receptores de acetilcolina (AChR) y los expresan en las regiones centrales en un proceso llamado preparación. Se cree que la agrina , un proteoglicano de heparina , y la quinasa MuSK ayudan a estabilizar la acumulación de AChR en las regiones centrales del miocito. MuSK es un receptor de tirosina quinasa, lo que significa que induce la señalización celular al unir moléculas de fosfato a regiones propias, como tirosinas , y a otros objetivos en el citoplasma . Tras la activación por su ligando agrina, MuSK envía señales a través de dos proteínas llamadas " Dok-7 " y " rapsyn ", para inducir el "agrupamiento" de los receptores de acetilcolina. La liberación de ACh por las neuronas motoras en desarrollo produce potenciales postsinápticos en la célula muscular que refuerzan positivamente la localización y estabilización de la unión neuromuscular en desarrollo.
Estos hallazgos fueron demostrados en parte por estudios de " knockout " en ratones . En ratones que son deficientes en agrina o MuSK, no se forma la unión neuromuscular. Además, los ratones deficientes en Dok-7 no formaron ni grupos de receptores de acetilcolina ni sinapsis neuromusculares.
El desarrollo de las uniones neuromusculares se estudia principalmente en organismos modelo, como los roedores. Además, en 2015 se creó una unión neuromuscular totalmente humana in vitro utilizando células madre embrionarias humanas y células madre musculares somáticas. En este modelo, las neuronas motoras presinápticas son activadas por optogenética y, en respuesta, las fibras musculares conectadas sinápticamente se contraen con la estimulación de la luz.
Métodos de búsqueda
José del Castillo y Bernard Katz utilizaron la ionoforesis para determinar la ubicación y densidad de los receptores nicotínicos de acetilcolina (nAChR) en la unión neuromuscular. Con esta técnica, se colocó un microelectrodo dentro de la placa motora terminal de la fibra muscular y se colocó una micropipeta llena de acetilcolina (ACh) directamente en frente de la placa terminal en la hendidura sináptica. Se aplicó un voltaje positivo a la punta de la micropipeta, lo que provocó la liberación de una explosión de moléculas de ACh cargadas positivamente de la pipeta. Estos ligandos fluyeron hacia el espacio que representa la hendidura sináptica y se unieron a los AChR. El microelectrodo intracelular monitorizó la amplitud de la despolarización de la placa motora terminal en respuesta a la unión de ACh a los receptores nicotínicos (ionotrópicos). Katz y del Castillo demostraron que la amplitud de la despolarización ( potencial postsináptico excitador ) dependía de la proximidad de la micropipeta que liberaba los iones ACh a la placa terminal. Cuanto más lejos estaba la micropipeta de la placa motora, menor era la despolarización en la fibra muscular. Esto permitió a los investigadores determinar que los receptores nicotínicos estaban localizados en la placa motora en alta densidad.
Las toxinas también se utilizan para determinar la ubicación de los receptores de acetilcolina en la unión neuromuscular. La α-Bungarotoxina es una toxina que se encuentra en la especie de serpiente Bungarus multicinctus que actúa como un antagonista de ACh y se une a los AChR de forma irreversible. Acoplando enzimas evaluables como la peroxidasa de rábano picante (HRP) o proteínas fluorescentes como la proteína verde fluorescente (GFP) a la α-bungarotoxina, los AChR se pueden visualizar y cuantificar.
Toxinas que afectan la unión neuromuscular.
Gases nerviosos
Los gases nerviosos y el licor dañan esta área.

Toxina botulínica
La toxina botulínica (también conocida como neurotoxina botulínica, y vendida bajo el nombre comercial Botox) inhibe la liberación de acetilcolina en la unión neuromuscular al interferir con las proteínas SNARE. Esta toxina atraviesa la terminal nerviosa a través del proceso de endocitosis y posteriormente interfiere con las proteínas SNARE, que son necesarias para la liberación de ACh. Al hacerlo, induce una parálisis flácida transitoria y una denervación química localizada en el músculo estriado que ha afectado. La inhibición de la liberación de ACh no se produce hasta aproximadamente dos semanas después de la inyección. Tres meses después de que ocurre la inhibición, la actividad neuronal comienza a recuperar la función parcial y seis meses, se recupera la función neuronal completa.
Toxina tetánica
La toxina del tétanos, también conocida como tetanospasmina, es una potente neurotoxina producida por Clostridium tetani y causa el estado patológico del tétanos. Se ha medido que la DL 50 de esta toxina es de aproximadamente 1 ng / kg, por lo que es la segunda después de la toxina botulínica D como la toxina más letal del mundo. Funciona de manera muy similar a la neurotoxina botulínica uniéndose y endocitosándose en la terminal nerviosa presináptica e interfiriendo con los complejos proteicos SNARE. Se diferencia de la neurotoxina botulínica en algunos aspectos, la mayoría aparentemente en su estado final, en el que la tetanoespasmina demuestra una parálisis rígida / espástica en contraposición a la parálisis flácida demostrada con la neurotoxina botulínica.
Latrotoxina
La latrotoxina (α-latrotoxina) que se encuentra en el veneno de las arañas viudas también afecta la unión neuromuscular al provocar la liberación de acetilcolina de la célula presináptica. Los mecanismos de acción incluyen la unión a receptores en la célula presináptica que activa la vía IP3 / DAG y la liberación de calcio de las reservas intracelulares y la formación de poros que resultan en la entrada directa de iones de calcio. Cualquiera de los dos mecanismos provoca un aumento de calcio en las células presinápticas, que luego conduce a la liberación de vesículas sinápticas de acetilcolina. La latrotoxina causa dolor, contracción muscular y, si no se trata, puede causar parálisis y muerte.
Veneno de serpiente
Los venenos de serpientes actúan como toxinas en la unión neuromuscular y pueden inducir debilidad y parálisis . Los venenos pueden actuar como neurotoxinas presinápticas y postsinápticas.
Las neurotoxinas presinápticas, comúnmente conocidas como β-neurotoxinas, afectan las regiones presinápticas de la unión neuromuscular. La mayoría de estas neurotoxinas actúan inhibiendo la liberación de neurotransmisores, como la acetilcolina, en la sinapsis entre neuronas. Sin embargo, también se sabe que algunas de estas toxinas mejoran la liberación de neurotransmisores. Aquellos que inhiben la liberación de neurotransmisores crean un bloqueo neuromuscular que evita que las moléculas de señalización lleguen a sus receptores objetivo postsinápticos. Al hacerlo, la víctima de estas mordeduras de serpiente sufre una profunda debilidad. Estas neurotoxinas no responden bien a los antídotos. Después de una hora de inoculación de estas toxinas, incluidas la notexina y la taipoxina , muchas de las terminales nerviosas afectadas muestran signos de daño físico irreversible, dejándolas desprovistas de vesículas sinápticas .
Las neurotoxinas postsinápticas, también conocidas como α-neurotoxinas, actúan de manera opuesta a las neurotoxinas presinápticas al unirse a los receptores postsinápticos de acetilcolina. Esto evita la interacción entre la acetilcolina liberada por el terminal presináptico y los receptores de la célula postsináptica. En efecto, la apertura de los canales de sodio asociados con estos receptores de acetilcolina está prohibida, lo que resulta en un bloqueo neuromuscular, similar a los efectos observados por las neurotoxinas presinápticas. Esto causa parálisis en los músculos involucrados en las uniones afectadas. A diferencia de las neurotoxinas presinápticas, las toxinas postsinápticas se ven más fácilmente afectadas por los antídotos, que aceleran la disociación de la toxina de los receptores y, en última instancia, provocan la reversión de la parálisis. Estas neurotoxinas ayudan de forma experimental y cualitativa en el estudio de la densidad y el recambio del receptor de acetilcolina , así como en estudios que observan la dirección de los anticuerpos hacia los receptores de acetilcolina afectados en pacientes diagnosticados con miastenia gravis .
Enfermedades
Cualquier trastorno que comprometa la transmisión sináptica entre una neurona motora y una célula muscular se clasifica bajo el término general de enfermedades neuromusculares . Estos trastornos pueden ser heredados o adquiridos y pueden variar en su gravedad y mortalidad. En general, la mayoría de estos trastornos tienden a ser causados por mutaciones o trastornos autoinmunes. Los trastornos autoinmunitarios, en el caso de enfermedades neuromusculares, tienden a ser mediados por humoral , mediados por células B y dan como resultado un anticuerpo creado incorrectamente contra una proteína de la neurona motora o de la fibra muscular que interfiere con la transmisión o señalización sináptica.
Autoinmune
Miastenia gravis
La miastenia gravis es un trastorno autoinmunitario en el que el cuerpo produce anticuerpos contra el receptor de acetilcolina (AchR) (en el 80% de los casos) o contra la quinasa postsináptica específica del músculo (MuSK) (0-10% de los casos). En la miastenia gravis seronegativa, la proteína 4 relacionada con el receptor de lipoproteínas de baja densidad está dirigida por IgG1 , que actúa como un inhibidor competitivo de su ligando, evitando que el ligando se una a su receptor. No se sabe si la miastenia gravis seronegativa responderá a las terapias estándar.
MG neonatal
La MG neonatal es un trastorno autoinmune que afecta a 1 de cada 8 niños nacidos de madres a las que se les ha diagnosticado miastenia gravis (MG). La MG se puede transferir de la madre al feto mediante el movimiento de los anticuerpos AChR a través de la placenta . Los signos de esta enfermedad al nacer incluyen debilidad, que responde a los medicamentos anticolinesterasa, así como acinesia fetal o falta de movimiento fetal. Esta forma de la enfermedad es transitoria y dura unos tres meses. Sin embargo, en algunos casos, la MG neonatal puede provocar otros efectos sobre la salud, como artrogriposis e incluso la muerte fetal. Se cree que estas condiciones se inician cuando los anticuerpos AChR maternos se dirigen al AChR fetal y pueden durar hasta la semana 33 de gestación , cuando la subunidad γ de AChR es reemplazada por la subunidad ε.
Síndrome miasténico de Lambert-Eaton
El síndrome miasténico de Lambert-Eaton (LEMS) es un trastorno autoinmune que afecta la porción presináptica de la unión neuromuscular. Esta rara enfermedad puede estar marcada por una tríada única de síntomas: debilidad muscular proximal, disfunción autonómica y arreflexia. La debilidad de los músculos proximales es producto de autoanticuerpos patógenos dirigidos contra los canales de calcio dependientes de voltaje de tipo P / Q, que a su vez conduce a una reducción de la liberación de acetilcolina de las terminales nerviosas motoras en la célula presináptica. Ejemplos de disfunción autonómica causada por LEMS incluyen disfunción eréctil en hombres, estreñimiento y, más comúnmente, boca seca . Las disfunciones menos comunes incluyen ojos secos y transpiración alterada . La arreflexia es una afección en la que se reducen los reflejos tendinosos y puede desaparecer temporalmente después de un período de ejercicio.
El 50-60% de los pacientes que son diagnosticados de LEMS también presentan un tumor asociado , típicamente carcinoma microcítico de pulmón (CPCP). Este tipo de tumor también expresa canales de calcio dependientes de voltaje . A menudo, LEMS también ocurre junto con la miastenia gravis.
El tratamiento para LEMS consiste en usar 3,4-diaminopiridina como primera medida, que sirve para aumentar el potencial de acción muscular compuesto, así como la fuerza muscular, alargando el tiempo que los canales de calcio dependientes de voltaje permanecen abiertos después de bloquear los canales de potasio dependientes de voltaje. En los EE. UU., El tratamiento con 3,4-diaminopiridina para pacientes elegibles con LEMS está disponible sin costo bajo un programa de acceso ampliado. El tratamiento adicional incluye el uso de prednisona y azatioprina en caso de que la 3,4-diaminopiridina no ayude en el tratamiento.
Neuromiotonía
La neuromiotonía (NMT), también conocida como síndrome de Isaac, es diferente a muchas otras enfermedades presentes en la unión neuromuscular. En lugar de causar debilidad muscular, la NMT conduce a la hiperexcitación de los nervios motores. La NMT causa esta hiperexcitación al producir despolarizaciones más largas al regular a la baja los canales de potasio activados por voltaje , lo que provoca una mayor liberación de neurotransmisores y disparos repetitivos. Este aumento en la tasa de disparo conduce a una transmisión más activa y, como resultado, a una mayor actividad muscular en el individuo afectado. También se cree que la NMT es de origen autoinmune debido a sus asociaciones con síntomas autoinmunes en el individuo afectado.
Genético
Síndromes miasténicos congénitos
Los síndromes miasténicos congénitos (CMS) son muy similares a MG y LEMS en sus funciones, pero la principal diferencia entre CMS y esas enfermedades es que CMS es de origen genético. Específicamente, estos síndromes son enfermedades provocadas por mutaciones, típicamente recesivas , en 1 de al menos 10 genes que afectan a las proteínas presinápticas, sinápticas y postsinápticas en la unión neuromuscular. Estas mutaciones suelen surgir en la subunidad ε de AChR, lo que afecta la cinética y la expresión del propio receptor. Las sustituciones o deleciones de un solo nucleótido pueden causar pérdida de función en la subunidad. Otras mutaciones , como las que afectan a la acetilcolinesterasa y la acetiltransferasa , también pueden provocar la expresión de CMS, estando esta última asociada específicamente a la apnea episódica . Estos síndromes pueden presentarse en diferentes momentos de la vida de un individuo. Pueden surgir durante la fase fetal, causando acinesia fetal , o el período perinatal, durante el cual se pueden observar ciertas condiciones, como artrogriposis , ptosis , hipotonía , oftalmoplejía y dificultades para alimentarse o respirar. También podrían activarse durante la adolescencia o la edad adulta, provocando que el individuo desarrolle el síndrome de canal lento.
El tratamiento para subtipos particulares de CMS (CMS postsinápticos de canal rápido) es similar al tratamiento para otros trastornos neuromusculares. La 3,4-diaminopiridina , el tratamiento de primera línea para LEMS, está en desarrollo como medicamento huérfano para CMS en los EE. UU. Y está disponible para pacientes elegibles bajo un programa de acceso ampliado sin costo.
Atrofia muscular bulboespinal
Atrofia muscular bulboespinal , también conocida como la enfermedad de Kennedy, es una rara recesiva trinucleótido, trastorno de poliglutamina que está vinculada a la cromosoma X . Debido a su vínculo con el cromosoma X, generalmente se transmite a través de las mujeres. Sin embargo, la enfermedad de Kennedy solo está presente en hombres adultos y la aparición de la enfermedad suele ser más tardía en la vida. Esta enfermedad está causada específicamente por la expansión de una repetición en tándem CAG en el exón 1 que se encuentra en el gen del receptor de andrógenos (AR) en el cromosoma Xq 11-12. El AR poli-Q-expandido se acumula en los núcleos de las células, donde comienza a fragmentarse. Después de la fragmentación, comienza la degradación de la célula, lo que conduce a la pérdida tanto de las neuronas motoras como de los ganglios de la raíz dorsal .
Los síntomas de la enfermedad de Kennedy incluyen debilidad y atrofia de los músculos bulbares faciales y de las extremidades, así como alteraciones sensoriales y endocrinológicas, como ginecomastia y reducción de la fertilidad . Otros síntomas incluyen niveles elevados de testosterona y otras hormonas sexuales, desarrollo de hiper-CK-emia, conducción anormal a través de los nervios motores y sensoriales y alteraciones neuropáticas o, en casos raros, miopáticas en biopsias de células musculares.
Distrofia muscular de Duchenne
La distrofia muscular de Duchenne es un trastorno genético ligado al cromosoma X que resulta en la ausencia de la proteína estructural distrofina en la unión neuromuscular. Afecta a 1 de cada 3600 a 6000 hombres y con frecuencia causa la muerte a la edad de 30 años. La ausencia de distrofina causa degeneración muscular y los pacientes presentan los siguientes síntomas: marcha anormal , hipertrofia en los músculos de la pantorrilla y creatina cinasa elevada . Si no se trata, los pacientes pueden sufrir dificultad respiratoria , lo que puede provocar la muerte.
Ver también
enlaces externos
- Imagen de histología: 21501lca - Sistema de aprendizaje de histología en la Universidad de Boston
Otras lecturas
- Kandel, ER ; Schwartz JH; Jessell TM. (2000). Principios de la ciencia neuronal (4ª ed.). Nueva York: McGraw-Hill. ISBN 0-8385-7701-6.
- Nicholls, JG; AR Martin; BG Wallace; PA Fuchs (2001). De la neurona al cerebro (4ª ed.). Sunderland, MA .: Sinauer Associates. ISBN 0-87893-439-1.
- Engel, AG (2004). Myology (3ª ed.). Nueva York: McGraw Hill Professional. ISBN 0-07-137180-X.


