Myxobolus cerebralis -Myxobolus cerebralis
| Myxobolus cerebralis | |
|---|---|
|
|
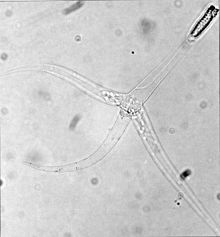
| Estadio Triactinomyxon de Myxobolus cerebralis - observe las tres "colas" | |
|
clasificación cientifica |
|
| Reino: | Animalia |
| Filo: | Cnidaria |
| Clase: | Myxosporea |
| Pedido: | Bivalvulida |
| Familia: | Myxobolidae |
| Género: | Myxobolus |
| Especies: |
M. cerebralis
|
| Nombre binomial | |
|
Myxobolus cerebralis
Hofer , 1903
|
|
| Sinónimos | |
|
Myxosoma cerebralis |
|
Myxobolus cerebralis es un myxosporean parásito de salmónidos ( salmón , trucha , y sus aliados) que causa la enfermedad del torneo en la cría de salmón y trucha y también en las poblaciones de peces silvestres . Se describió por primera vez en la trucha arco iris en Alemania hace un siglo, pero su área de distribución se ha extendido y ha aparecido en la mayor parte de Europa (incluida Rusia), Estados Unidos, Sudáfrica, Canadá y otros países. En la década de 1980,se descubrió que M. cerebralis requería un oligoqueto tubificido (una especie de gusano segmentado ) para completar su ciclo de vida. El parásito infecta a sus huéspedes con sus células después de perforarlas con filamentos polares expulsados decápsulas similares a nematocistos .
La enfermedad de los remolinos afecta a los peces jóvenes (alevines y alevines) y causa deformaciones esqueléticas y daños neurológicos . Los peces "giran" hacia adelante en un patrón torpe, parecido a un sacacorchos, en lugar de nadar normalmente, les resulta difícil alimentarse y son más vulnerables a los depredadores . La tasa de mortalidad es alta para los alevines, hasta el 90% de las poblaciones infectadas, y los que sobreviven son deformados por los parásitos que residen en sus cartílagos y huesos . Actúan como un depósito del parásito, que se libera en el agua después de la muerte del pez. M. cerebralis es uno de los mixozoos de mayor importancia económica en los peces, así como uno de los más patógenos. Fue el primer myxosporean cuya patología y síntomas fueron descritos científicamente. El parásito no se transmite a los humanos.
Taxonomía
La taxonomía y la denominación de M. cerebralis y de los mixozoos en general tienen historias complicadas. Originalmente se pensó que infectaba el cerebro de los peces (de ahí el epíteto cerebralis específico ) y el sistema nervioso , aunque pronto se descubrió que infectaba principalmente el cartílago y el tejido esquelético . Los intentos de cambiar el nombre a Myxobolus chondrophagus , que describiría con mayor precisión al organismo, fracasaron debido a las reglas de nomenclatura . Más tarde, se descubrió que los organismos anteriormente llamados Triactinomyxon dubium y T. gyrosalmo ( clase Actinosporea ) eran, de hecho, etapas de triactinomyxon de M. cerebralis , cuyo ciclo de vida se amplió para incluir la etapa de triactinomyxon. De manera similar, otros actinosporeos se incorporaron a los ciclos de vida de varios mixosporeos.
Hoy en día, los mixozoos, que antes se pensaba que eran protozoos multicelulares , son considerados animales por la mayoría de los científicos, aunque su estatus no ha cambiado oficialmente. Estudios moleculares recientes sugieren que están relacionados con Bilateria o Cnidaria , siendo Cnidaria más cercano morfológicamente porque ambos grupos tienen filamentos extrusivos. La bilateria estaba algo más cerca en algunos estudios genéticos, pero se encontró que se usaron muestras que estaban contaminadas con material del organismo huésped, y un estudio de 2015 confirma que son cnidarios.
Morfología
M. cerebralis tiene muchas etapas diversas que van desde células individuales hasta esporas relativamente grandes, no todas las cuales se han estudiado en detalle.
Estadio de triactinomixón
Las etapas que infectan a los peces, llamadas esporas de triactinomixon , están hechas de un solo estilo que mide aproximadamente 150 micrómetros (μm) de largo y tres procesos o "colas", cada uno de unos 200 micrómetros de largo. Un paquete de esporoplasma al final del estilo contiene 64 células germinales rodeadas por una envoltura celular. También hay tres cápsulas polares , cada una de las cuales contiene un filamento polar enrollado de entre 170 y 180 μm de largo. Los filamentos polares tanto en esta etapa como en la etapa de mixosporas (ver imagen de arriba) se disparan rápidamente hacia el cuerpo del huésped, creando una abertura a través de la cual puede ingresar el esporoplasma.
Estadio de esporoplasma
Al entrar en contacto con peces hospedadores y disparar las cápsulas polares, el esporoplasma contenido dentro del estilo central del triactinomixon migra hacia el epitelio o el revestimiento intestinal. En primer lugar, este esporoplasma sufre mitosis para producir más células ameboides , que migran a capas de tejido más profundas, para llegar al cartílago cerebral.
Etapa mixospora
Las mixosporas, que se desarrollan a partir de etapas de células esporogónicas dentro de los peces hospedadores, son lenticulares. Tienen un diámetro de unos 10 micrómetros y están formados por seis celdas. Dos de estas células forman cápsulas polares, dos se fusionan para formar un esporoplasma binucleado y dos forman válvulas protectoras. Las mixosporas son infecciosas para los oligoquetos y se encuentran entre los restos de cartílago de pescado digerido. A menudo son difíciles de distinguir de las especies relacionadas debido a las similitudes morfológicas entre los géneros . Aunque M. cerebralis es el único mixospora que se ha encontrado en el cartílago de los salmónidos, otras especies visualmente similares pueden estar presentes en la piel, el sistema nervioso o los músculos .
Ciclo vital
Myxobolus cerebralis tiene un ciclo de vida de dos huéspedes que involucra un pez salmónido y un oligoqueto tubícico. Hasta ahora, el único gusano que se sabe que es susceptible a la infección por M. cerebralis es Tubifex tubifex , aunque lo que los científicos llaman actualmente T. tubifex puede ser de hecho más de una especie. En primer lugar, los gusanos tubíficidos ingieren las mixosporas. En la luz intestinal del gusano, las esporas extruyen sus cápsulas polares y se adhieren al epitelio intestinal mediante filamentos polares . A continuación, las válvulas de la cáscara se abren a lo largo de la línea de sutura y la célula germinal binucleada penetra entre las células epiteliales intestinales del gusano. Esta célula se multiplica y produce muchas células ameboides mediante un proceso de fisión celular asexual llamado merogonía . Como resultado del proceso de multiplicación, el espacio intercelular de las células epiteliales en más de 10 segmentos de gusanos vecinos puede infectarse.
Alrededor de 60 a 90 días después de la infección, las etapas de células sexuales del parásito experimentan esporogénesis y se convierten en pansporoquistes , cada uno de los cuales contiene ocho esporas en etapa de triactinomixón. Estas esporas se liberan del ano oligoqueto al agua. Alternativamente, un pez puede infectarse al comer un oligoqueto infectado. Los tubícidos infectados pueden liberar triactinomixones durante al menos un año. Las esporas de triactinomyxon son transportadas por las corrientes de agua, donde pueden infectar a un salmónido a través de la piel. La penetración de los peces por estas esporas toma solo unos segundos. En cinco minutos, un saco de células germinales llamado esporoplasma ha entrado en la epidermis del pez y, en unas pocas horas, el esporoplasma se divide en células individuales que se propagarán a través del pez.
Dentro del pez, tanto las etapas intracelulares como extracelulares se reproducen en su cartílago por endogenia asexual , lo que significa que nuevas células crecen desde dentro de las células viejas. La etapa final dentro del pez es la creación de la mixospora, que está formada por esporogonía . Se liberan al medio ambiente cuando el pescado se descompone o se come. Algunas investigaciones recientes indican que algunos peces pueden expulsar mixosporas viables mientras aún están vivos.
Las mixosporas son extremadamente resistentes: "se demostró que las esporas de Myxobolus cerebralis pueden tolerar la congelación a -20 ° C durante al menos 3 meses, el envejecimiento en lodo a 13 ° C durante al menos 5 meses y el paso a través de las entrañas del lucio del norte Esox lucius o ánades reales Anas platyrhynchos sin pérdida de infectividad "a los gusanos. Los triactinomixones tienen una vida mucho más corta y sobreviven 34 días o menos, según la temperatura.
Patología

Se han informado infecciones por M. cerebralis en una amplia gama de especies de salmónidos: ocho especies de salmónidos "atlánticos", Salmo ; cuatro especies de salmónidos del "Pacífico", Oncorhynchus ; cuatro especies de char, Salvelinus ; el tímalo, Thymallus thymallus ; y el huchen, Hucho hucho . M. cerebralis causa daño a sus peces hospedadores a través de la unión de esporas de triactinomyxon y las migraciones de varias etapas a través de los tejidos y a lo largo de los nervios, así como al digerir el cartílago. La cola del pez puede oscurecerse, pero aparte de las lesiones en el cartílago, los órganos internos generalmente parecen sanos. Otros síntomas incluyen deformidades esqueléticas y comportamiento "giratorio" (persecución de la cola) en los peces jóvenes, que se pensaba que había sido causado por una pérdida de equilibrio, pero que en realidad es causado por daño a la médula espinal y el tronco encefálico inferior. Los experimentos han demostrado que los peces pueden matar Myxobolus en su piel (posiblemente usando anticuerpos ), pero que los peces no atacan a los parásitos una vez que han migrado al sistema nervioso central. Esta respuesta varía de una especie a otra.
En T. tubifex , la liberación de esporas de triactinomyxon de la pared intestinal daña la mucosa del gusano ; esto puede suceder miles de veces en un solo gusano y se cree que perjudica la absorción de nutrientes. Las esporas se liberan del gusano casi exclusivamente cuando la temperatura está entre 10 ° C y 15 ° C, por lo que los peces en aguas más cálidas o más frías tienen menos probabilidades de infectarse y las tasas de infección varían según la estación.
Susceptibilidad
El tamaño de los peces, la edad, la concentración de esporas de triactinomixon y la temperatura del agua afectan las tasas de infección en los peces, al igual que las especies de peces en cuestión. La enfermedad tiene el mayor impacto en los peces de menos de cinco meses porque sus esqueletos no se han osificado . Esto hace que los peces jóvenes sean más susceptibles a las deformidades y proporciona a M. cerebralis más cartílago del que alimentarse. En un estudio de siete especies de muchas cepas, la trucha de arroyo y la trucha arco iris (excepto una cepa) fueron mucho más afectadas por M. cerebralis después de dos horas de exposición que otras especies, mientras que la trucha toro , el salmón chinook , la trucha marrón y El tímalo ártico fue el menos afectado. Si bien la trucha marrón puede albergar el parásito, por lo general no muestra ningún síntoma, y esta especie puede haber sido el huésped original de M. cerebralis . Esta falta de síntomas en la trucha marrón significó que el parásito solo se descubrió después de que las truchas arco iris no nativas se introdujeran en Europa.
Diagnóstico
La infección clínica moderada o grave de los peces con enfermedad giratoria se puede diagnosticar presuntamente sobre la base de cambios en el comportamiento y la apariencia entre 35 y 80 días después de la infección inicial, aunque "la lesión o la deficiencia de triptófano y ácido ascórbico en la dieta pueden provocar signos similares", por lo que El diagnóstico concluyente puede requerir encontrar mixosporas en el cartílago del pez. En infecciones graves, solo puede ser necesario examinar el cartílago microscópicamente para encontrar esporas. En infecciones menos graves, la prueba más común implica la digestión del cartílago craneal con las proteasas pepsina y tripsina (digestión de pepsina-tripsina, PTD) antes de buscar esporas. La cabeza y otros tejidos se pueden examinar más a fondo utilizando histopatología para confirmar si la ubicación y morfología de las esporas coincide con lo que se conoce para M. cerebralis . También es posible la identificación serológica de esporas en secciones de tejido utilizando un anticuerpo producido contra las esporas. Identidad parásito también puede ser confirmada usando la reacción en cadena de la polimerasa para amplificar el par de bases 415 18S rRNA gen de M. cerebralis . Los peces deben cribarse en la etapa de vida más susceptible a los parásitos, con especial atención a los peces de las unidades de acuicultura.
Impacto

Aunque originalmente era un patógeno leve de Salmo trutta en Europa central y otros salmónidos en el noreste de Asia, la introducción de la trucha arco iris ( Oncorhynchus mykiss ) ha aumentado considerablemente el impacto de este parásito. Al no tener inmunidad innata a M. cerebralis , las truchas arco iris son particularmente susceptibles y pueden liberar tantas esporas que incluso las especies más resistentes en la misma área, como S. trutta , pueden sobrecargarse de parásitos y provocar entre un 80% y un 90% de mortalidad. . Donde M. cerebralis se ha establecido bien, ha provocado la disminución o incluso la eliminación de cohortes enteras de peces.
Impacto en Europa
El impacto de M. cerebralis en Europa se ha reducido un poco porque la especie es endémica de esta región, lo que confiere a las poblaciones de peces nativos un grado de inmunidad . La trucha arco iris, la especie más susceptible a este parásito, no es originaria de Europa; las poblaciones silvestres que se reproducen con éxito son raras, por lo que pocas truchas arcoíris silvestres son lo suficientemente jóvenes como para ser susceptibles a la infección. Por otro lado, son ampliamente criados para la repoblación en aguas de pesca deportiva y para la acuicultura , donde este parásito tiene su mayor impacto. Los métodos de incubación y cría diseñados para prevenir la infección de los alevines de trucha arco iris han tenido éxito en Europa. Estas técnicas incluyen la incubación de huevos en agua sin esporas y la cría de alevines hasta la etapa de "osificación" en tanques o canales. Estos métodos prestan especial atención a la calidad de las fuentes de agua para evitar la introducción de esporas durante los intercambios de agua. Los alevines se trasladan a estanques de tierra solo una vez que se consideran clínicamente resistentes al parásito, después de que se produce la osificación esquelética.
Impacto en Nueva Zelanda
M. cerebralis se encontró por primera vez en Nueva Zelanda en 1971. El parásito solo se ha encontrado en ríos de la Isla Sur, lejos de los sitios de acuicultura más importantes. Además, las especies de salmónidos que se cultivan comercialmente en Nueva Zelanda tienen una baja susceptibilidad a la enfermedad del remolino, y tampoco se ha demostrado que el parásito afecte a los salmónidos nativos. Un efecto indirecto importante de la presencia de parásitos es la restricción de cuarentena impuesta a las exportaciones de productos de salmón a Australia.
Impacto en Estados Unidos

M. cerebralis se registró por primera vez en América del Norte en 1956 en Pensilvania , habiendo sido introducida a través de truchas infectadas importadas de Europa, y se ha extendido constantemente hacia el sur y el oeste. Hasta la década de 1990, la enfermedad de los remolinos se consideraba un problema manejable que afectaba a la trucha arco iris en los criaderos. Sin embargo, recientemente se ha establecido en aguas naturales de los estados de las Montañas Rocosas ( Colorado , Wyoming , Utah , Montana , Idaho , Nuevo México ), donde está provocando una gran mortalidad en varios ríos de pesca deportiva. Algunos arroyos del oeste de Estados Unidos han perdido el 90% de sus truchas. Además, la enfermedad de los remolinos amenaza la pesca recreativa, que es importante para la industria del turismo, un componente clave de las economías de algunos estados del oeste de Estados Unidos. Por ejemplo, "el Grupo de Trabajo sobre Enfermedades Remolinas de Montana estimó que la pesca de truchas generó 300 millones de dólares en gastos recreativos solo en Montana". Para empeorar las cosas, algunas de las especies de peces que infecta M. cerebralis ( trucha toro , trucha degollada y trucha arco iris ) ya están amenazadas o en peligro de extinción , y el parásito podría empeorar sus ya precarias situaciones. Por razones que no se comprenden bien, pero que probablemente tienen que ver con las condiciones ambientales, el impacto en los peces infectados ha sido mayor en Colorado y Montana, y menor en California , Michigan y Nueva York.
Impacto en Canadá
La enfermedad por remolinos se detectó por primera vez en peces en el lago Johnson en el Parque Nacional Banff en mayo de 2016. CFIA Labs confirmó en agosto y Parks Canada anunció el brote el 23 de agosto de 2016. Aunque se descubrió por primera vez en Banff, no es necesariamente el lugar donde la enfermedad originado y difundido. El Gobierno de Alberta está tomando muestras y analizando peces en 6 cuencas hidrográficas diferentes (Peace River, Athabasca, North Saskatchewan, Red Deer, Bow y Oldman) para ver dónde se ha propagado la enfermedad. Los peces de muestra inicial se recolectaron en 2016 y actualmente están siendo procesados por los laboratorios del Gobierno de Alberta y la CFIA. Desde que comenzaron las pruebas, se ha detectado en el río Upper Bow, y en mayo de 2017 se confirmó que también se había detectado la enfermedad de los remolinos en la cuenca del río Oldman. La declaración no significa que todas las poblaciones de peces susceptibles dentro de las cuencas hidrográficas de los ríos Bow y Oldman estén infectadas con la enfermedad.
Como resultado de la nueva declaración, se requerirá un permiso de movimiento doméstico de la CFIA para especies susceptibles y usos finales identificados en el Programa de Control de Movimiento Doméstico, el vector Tubifex tubifex , el agente causante de enfermedades Myxobolus cerebralis y / o cosas relacionadas. de las áreas infectadas y tampón de Alberta. La pesca recreativa y deportiva, incluida la pesca dirigida por un guía profesional, no requerirá un permiso de la CFIA.
Prevención y control
Algunos biólogos han intentado desarmar las esporas de triactinomyxon haciéndolas disparar prematuramente. En el laboratorio, solo la acidez o basicidad extremas , las concentraciones de sales moderadas a altas o la corriente eléctrica provocaron la descarga prematura del filamento; Los neuroquímicos, los quimiosensibilizadores cnidarios y el moco de la trucha fueron ineficaces, al igual que los peces anestesiados o muertos. Si las esporas pudieran desarmarse, no podrían infectar a los peces, pero se necesita más investigación para encontrar un tratamiento efectivo.
Algunas cepas de pescado son más resistentes que otras, incluso dentro de una especie; el uso de cepas resistentes puede ayudar a reducir la incidencia y la gravedad de la enfermedad por remolinos en la acuicultura. También existe alguna evidencia circunstancial de que las poblaciones de peces pueden desarrollar resistencia a la enfermedad con el tiempo. Además, los acuicultores pueden evitar las infecciones por M. cerebralis al no utilizar estanques de tierra para criar peces jóvenes; esto los mantiene alejados de los tubícidos posiblemente infectados y facilita la eliminación de esporas y oligoquetos mediante filtración, cloración y bombardeo ultravioleta. Para minimizar las poblaciones de tubífidos, las técnicas incluyen la desinfección periódica de los estanques de incubación o acuicultura y la cría de truchas pequeñas en interiores en agua libre de patógenos. Los conductos de concreto de cara lisa o revestidos de plástico que se mantienen limpios y libres de agua contaminada mantienen las instalaciones de acuicultura libres de la enfermedad.
Por último, se ha demostrado que algunos fármacos, como furazolidona , furoxona , benomil , fumagilina , proguanil y clamoxicina , impiden el desarrollo de esporas, lo que reduce las tasas de infección. Por ejemplo, un estudio mostró que la alimentación con fumagilina a O. mykiss redujo el número de peces infectados de entre un 73% y un 100% a entre un 10% y un 20%. Desafortunadamente, este tratamiento se considera inadecuado para las poblaciones de truchas silvestres, y ningún tratamiento farmacológico ha demostrado ser efectivo en los estudios requeridos para la aprobación de la Administración de Drogas y Alimentos de los Estados Unidos .
Los pescadores recreativos y deportivos pueden ayudar a prevenir la propagación del parásito al no transportar peces de un cuerpo de agua a otro, no desechar espinas o entrañas de pescado en ningún cuerpo de agua y asegurarse de que las botas y los zapatos estén limpios antes de moverse entre diferentes cuerpos. de agua. Se deben seguir las regulaciones federales, estatales, provinciales y locales sobre el uso de cebos .
Ver también
- Ceratomyxa shasta - otro parásito myxosporean patógeno de salmónidos
- Anemia infecciosa del salmón (ISA): una infección viral del salmón del Atlántico
- Tiritas de Kudoa : un parásito mixospora de muchas especies, que hace que los tejidos de los peces se licúen al morir
- Tetracapsuloides bryosalmonae : el enigmático myxosporean que causa la "enfermedad renal proliferativa" en los salmónidos
- Susceptibilidad de los salmónidos a la enfermedad de los remolinos
Notas
enlaces externos
- Informe de la Organización Mundial del Comercio sobre las restricciones australianas a las importaciones de salmón
- La iniciativa Whirling Disease
- Mapas y datos de enfermedades giratorias
- Perfil de la especie - Enfermedad del remolino ( Myxobolus cerebralis ) , Centro Nacional de Información sobre Especies Invasoras, Biblioteca Agrícola Nacional de los Estados Unidos , enumera información general y recursos para la enfermedad del remolino
- Enfermedad de los remolinos - Parque Nacional de Yellowstone (Servicio de Parques Nacionales de EE. UU.)
- Enfermedad de los remolinos - Detengan a los autostopistas acuáticos
- Enfermedad de los remolinos - División de Recursos de Vida Silvestre de Utah
- Parques y vida silvestre de Colorado: enfermedad de los remolinos y trucha de Colorado
- ¿Qué es la enfermedad de los remolinos? - Centro de Acuicultura Regional Centro-Norte - Mohamed Faisal - Donald Garling
- Enfermedad de los remolinos | Alberta.ca



