Mycobacterium tuberculosis -Mycobacterium tuberculosis
| Tuberculosis micobacteriana | |
|---|---|

|
|
| Colonias de M. tuberculosis | |
| clasificación cientifica | |
| Dominio: | |
| Filo: |
" Actinobacterias "
|
| Clase: | |
| Pedido: | |
| Familia: | |
| Género: | |
| Especies: |
M. tuberculosis
|
| Nombre binomial | |
|
Tuberculosis micobacteriana Zopf 1883
|
|
| Sinónimos | |
|
Bacilo del tubérculo Koch 1882 |
|
Mycobacterium tuberculosis (M. tb) es una especie de bacteria patógena de la familia Mycobacteriaceae y el agente causante de la tuberculosis . Descubierta por primera vez en 1882 por Robert Koch , M. tuberculosis tiene una inusual capa cerosa en la superficie celular debido principalmente a la presencia de ácido micólico . Este recubrimiento hace que las células sean inmunes a la tinción de Gram y, como resultado, M. tuberculosis puede parecer débilmente Gram-positiva. Tinciones resistentes al ácido como Ziehl-Neelsen otinciones fluorescentes como la auraminase utilizan en su lugar para identificar M. tuberculosis con un microscopio. La fisiología de M. tuberculosis es altamente aeróbica y requiere altos niveles de oxígeno. Principalmente un patógeno del sistema respiratorio de los mamíferos , infecta los pulmones. Los métodos de diagnóstico más utilizados para la tuberculosis son la prueba cutánea de la tuberculina , la tinción acidorresistente , el cultivo y la reacción en cadena de la polimerasa .
El genoma de M. tuberculosis se secuenció en 1998.
Microbiología
M. tuberculosis se encontró en 2019 un complejo que tiene al menos 9 miembros: M. tuberculosis sensu stricto , M. africanum , M. canetti , M. bovis , M. caprae , M. microti , M. pinnipedii , M. mungi , y M. orygis . Se requiere oxígeno para crecer , se debate si se produce esporas , y es no móviles . M. tuberculosis se divide cada 18 a 24 horas. Esto es extremadamente lento en comparación con otras bacterias, que tienden a tener tiempos de división medidos en minutos ( Escherichia coli puede dividirse aproximadamente cada 20 minutos). Es un pequeño bacilo que puede soportar desinfectantes débiles y puede sobrevivir en estado seco durante semanas. Su pared celular inusual es rica en lípidos como el ácido micólico, probablemente es responsable de su resistencia a la desecación y es un factor clave de virulencia .
Microscopía
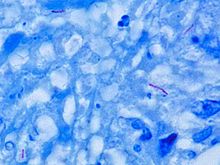
Otras bacterias se identifican comúnmente con un microscopio tiñéndolas con tinción de Gram . Sin embargo, el ácido micólico de la pared celular de M. tuberculosis no absorbe la mancha. En su lugar, se utilizan tintes resistentes a los ácidos, como el tinte Ziehl-Neelsen , o tintes fluorescentes, como la auramina . Las células tienen forma de varilla curva y a menudo se ven envueltas, debido a la presencia de ácidos grasos en la pared celular que se adhieren entre sí. Esta apariencia se conoce como cuerda, como hebras de cuerda que forman una cuerda. M. tuberculosis se caracteriza en el tejido por granulomas caseificantes que contienen células gigantes de Langhans , que tienen un patrón de núcleos en "herradura".
Cultura
M. tuberculosis se puede cultivar en el laboratorio. En comparación con otras bacterias comúnmente estudiadas, M. tuberculosis tiene una tasa de crecimiento notablemente lenta, que se duplica aproximadamente una vez al día. Los medios de uso común incluyen líquidos como Middlebrook 7H9 o 7H12, medios sólidos a base de huevo como Lowenstein-Jensen y agar sólido a base de agar como Middlebrook 7H11 o 7H10 . Las colonias visibles requieren varias semanas para crecer en placas de agar. Se distingue de otras micobacterias por su producción de catalasa y niacina . Otras pruebas para confirmar su identidad incluyen sondas genéticas y MALDI-TOF .
Fisiopatología
Los seres humanos son los únicos reservorios conocidos de M. tuberculosis . Un concepto erróneo es que M. tuberculosis se puede contagiar al dar la mano, al hacer contacto con los asientos del inodoro, al compartir comida o bebida o al compartir cepillos de dientes. Besar podría ser una posible vía de transmisión si la persona excreta muchas micobacterias a través del esputo. Sin embargo, la mayor propagación se produce a través de las gotas de aire que se originan en una persona que tiene la enfermedad al toser, estornudar, hablar o cantar.
Cuando está en los pulmones, M. tuberculosis es fagocitado por macrófagos alveolares , pero son incapaces de matar y digerir la bacteria. Su pared celular evita la fusión del fagosoma con el lisosoma , que contiene una gran cantidad de factores antibacterianos. Específicamente, M. tuberculosis bloquea la molécula puente, el autoantígeno endosómico temprano 1 ( EEA1 ); sin embargo, este bloqueo no evita la fusión de vesículas llenas de nutrientes. En consecuencia, las bacterias se multiplican sin control dentro del macrófago. Las bacterias también portan el gen UreC , que evita la acidificación del fagosoma. Además, la producción del diterpeno isotuberculosinol previene la maduración del fagosoma. La bacteria también evade la muerte de los macrófagos al neutralizar los intermediarios de nitrógeno reactivo. Más recientemente, se ha demostrado que M. tuberculosis secreta y se cubre con 1-tuberculosiniladenosina (1-TbAd), un nucleósido especial que actúa como antiácido , lo que le permite neutralizar el pH e inducir la inflamación de los lisosomas. El 1-TbAd está codificado por el gen Rv3378c .
En las infecciones por M. tuberculosis , se encontró que los niveles de PPM1A estaban regulados positivamente y esto, a su vez, afectaría la respuesta apoptótica normal de los macrófagos a los patógenos claros, ya que PPM1A está involucrado en las vías apoptóticas intrínsecas y extrínsecas. Por tanto, cuando aumentaron los niveles de PPM1A, su expresión inhibe las dos vías apoptóticas. Con el análisis de kinoma, se descubrió que la vía de señalización de JNK / AP-1 es un efector corriente abajo en el que PPM1A tiene un papel que desempeñar, y la vía apoptótica en los macrófagos se controla de esta manera. Como resultado de la supresión de la apoptosis, le proporciona a M. tuberculosis un nicho replicativo seguro, por lo que las bacterias pueden mantener un estado latente durante un tiempo prolongado.
Los granulomas protectores se forman debido a la producción de citocinas y la regulación positiva de proteínas involucradas en el reclutamiento. Las lesiones granulotomatosas son importantes tanto para regular la respuesta inmune como para minimizar el daño tisular. Además, las células T ayudan a mantener Mycobacterium dentro de los granulomas.
La capacidad de construir mutantes de M. tuberculosis y probar productos genéticos individuales para funciones específicas ha avanzado significativamente en la comprensión de su patogénesis y factores de virulencia . Se sabe que muchas proteínas secretadas y exportadas son importantes en la patogénesis. Por ejemplo, uno de esos factores de virulencia es el factor del cordón (dimicolato de trehalosa), que sirve para aumentar la supervivencia dentro de su huésped. Las cepas resistentes de M. tuberculosis han desarrollado resistencia a más de un fármaco antituberculoso debido a mutaciones en sus genes. Además, los medicamentos antituberculosos de primera línea preexistentes, como la rifampicina y la estreptomicina, han disminuido su eficacia para eliminar M. tuberculosis intracelular debido a que no pueden penetrar eficazmente en el nicho de los macrófagos.
JNK juega un papel clave en el control de las vías apoptóticas, intrínsecas y extrínsecas. Además, también se encuentra que es un sustrato de la actividad de PPM1A, por lo que la fosforilación de JNK causaría que ocurriera la apoptosis. Dado que los niveles de PPM1A se elevan durante las infecciones por M. tuberculosis , al inhibir las vías de señalización de PPM1A, podría ser un método terapéutico para matar macrófagos infectados por M. tuberculosis al restaurar su función apoptótica normal en defensa de patógenos. Al apuntar a la vía del eje de señalización PPM1A-JNK, podría eliminar los macrófagos infectados con M. tuberculosis .
La capacidad de restaurar la apoptosis de los macrófagos en los infectados por M. tuberculosis podría mejorar el tratamiento de quimioterapia antituberculosa actual, ya que los medicamentos antituberculosos pueden tener un mejor acceso a las bacterias en el nicho. disminuyendo así los tiempos de tratamiento para las infecciones por M. tuberculosis .
Los síntomas de M. tuberculosis incluyen tos que dura más de tres semanas, hemoptisis , dolor de pecho al respirar o toser, pérdida de peso, fatiga, fiebre, sudores nocturnos, escalofríos y pérdida del apetito. M. tuberculosis también tiene el potencial de extenderse a otras partes del cuerpo. Esto puede causar sangre en la orina si los riñones están afectados y dolor de espalda si la columna vertebral se ve afectada.
Variación de tensión
La tipificación de las cepas es útil en la investigación de brotes de tuberculosis, porque le da al investigador evidencia a favor o en contra de la transmisión de persona a persona. Considere la situación en la que la persona A tiene tuberculosis y cree que la adquirió de la persona B. Si las bacterias aisladas de cada persona pertenecen a diferentes tipos, entonces la transmisión de B a A está definitivamente refutada; sin embargo, si las bacterias son de la misma cepa, entonces esto apoya (pero no prueba definitivamente) la hipótesis de que B infectó a A.
Hasta principios de la década de 2000, las cepas de M. tuberculosis se tipificaban mediante electroforesis en gel de campo pulsado . Esto ahora ha sido reemplazado por números variables de repeticiones en tándem (VNTR), que es técnicamente más fácil de realizar y permite una mejor discriminación entre cepas. Este método hace uso de la presencia de secuencias de ADN repetidas dentro del genoma de M. tuberculosis .
Se anotan tres generaciones de tipificación VNTR para M. tuberculosis . El primer esquema, llamado repetición exacta en tándem, usó solo cinco loci, pero la resolución proporcionada por estos cinco loci no fue tan buena como la PFGE. El segundo esquema, llamado unidad repetitiva intercalada micobacteriana, tenía una discriminación tan buena como PFGE. La tercera generación (unidad repetitiva intercalada de micobacterias - 2) agregó nueve loci más para llevar el total a 24. Esto proporciona un grado de resolución mayor que el PFGE y actualmente es el estándar para tipificar M. tuberculosis . Sin embargo, con respecto a los restos arqueológicos, es posible que se requieran pruebas adicionales debido a la posible contaminación por bacterias del suelo relacionadas.
La resistencia a los antibióticos en M. tuberculosis generalmente se produce debido a la acumulación de mutaciones en los genes a los que se dirige el antibiótico o a un cambio en la titulación del fármaco. M. tuberculosis se considera resistente a múltiples fármacos (TB MDR) si ha desarrollado resistencia a fármacos tanto a la rifampicina como a la isoniazida, que son los antibióticos más importantes utilizados en el tratamiento. Además, M. tuberculosis extensamente resistente a los medicamentos (XDR TB) se caracteriza por la resistencia tanto a la isoniazida como a la rifampicina, además de cualquier fluoroquinolona y al menos uno de los tres medicamentos inyectables de segunda línea (es decir, amikacina, kanamicina o capreomicina).
Genoma
El genoma de la cepa H37Rv se publicó en 1998. Su tamaño es de 4 millones de pares de bases, con 3.959 genes; El 40% de estos genes ha tenido su función caracterizada, con una posible función postulada para otro 44%. Dentro del genoma también hay seis pseudogenes .
El genoma contiene 250 genes involucrados en el metabolismo de los ácidos grasos , 39 de ellos involucrados en el metabolismo de los policétidos generando la capa cerosa. Un número tan elevado de genes conservados muestra la importancia evolutiva del pelaje ceroso para la supervivencia de los patógenos. Además, los estudios experimentales han validado desde entonces la importancia de un metabolismo de lípidos para M. tuberculosis , que consiste enteramente en lípidos derivados del huésped, como grasas y colesterol. Se demostró que las bacterias aisladas de los pulmones de ratones infectados utilizan preferentemente ácidos grasos sobre sustratos de carbohidratos. M. tuberculosis también puede crecer en el colesterol lipídico como única fuente de carbono, y los genes involucrados en la (s) vía (s) de uso del colesterol se han validado como importantes durante varias etapas del ciclo de vida de la infección de M. tuberculosis , especialmente durante la fase crónica. de infección cuando es probable que no haya otros nutrientes disponibles.
Aproximadamente el 10% de la capacidad de codificación es absorbida por las familias de genes PE / PPE que codifican proteínas ácidas ricas en glicina. Estas proteínas tienen un motivo N-terminal conservado, cuya eliminación altera el crecimiento en macrófagos y granulomas.
Se han caracterizado nueve ARNs no codificantes en M. tuberculosis , y se han predicho otros 56 en una pantalla bioinformática .
En 2013, se realizó un estudio sobre el genoma de varias cepas de M. tuberculosis sensibles, ultrarresistentes y multirresistentes para estudiar los mecanismos de resistencia a los antibióticos. Los resultados revelan nuevas relaciones y genes de resistencia a los fármacos no asociados previamente y sugieren que algunos genes y regiones intergénicas asociados con la resistencia a los fármacos pueden estar involucrados en la resistencia a más de un fármaco. Es de destacar el papel de las regiones intergénicas en el desarrollo de esta resistencia, y la mayoría de los genes propuestos en este estudio como responsables de la farmacorresistencia tienen un papel fundamental en el desarrollo de M. tuberculosis .
Evolución
El complejo M. tuberculosis evolucionó en África y muy probablemente en el Cuerno de África . Además de M. tuberculosis , el complejo M. tuberculosis (MTBC) tiene varios miembros que infectan a varias especies animales, entre las que se incluyen M. africanum , M. bovis (bacilo de Dassie), M. caprae , M. microti , M. mungi , M. orygis y M. pinnipedii . Este grupo también puede incluir el clado M. canettii . Estas cepas animales de MTBC no merecen estrictamente el estatus de especie, ya que todas están estrechamente relacionadas y incluidas en la filogenia de M. tuberculosis , pero por razones históricas, actualmente tienen el estatus de especie.
El clado M. canettii , que incluye M. prototuberculosis , es un grupo de especies de Mycobacterium de colonias lisas . A diferencia de los miembros establecidos del grupo M. tuberculosis , se recombinan con otras especies. La mayoría de las cepas conocidas de este grupo se han aislado en el Cuerno de África. El antepasado de M. tuberculosis parece ser M. canettii , descrito por primera vez en 1969.
Los miembros establecidos del complejo M. tuberculosis son todos clonales en su diseminación. Las principales especies que infectan a los seres humanos se han clasificado en siete linajes. Traduciendo estos linajes a la terminología usada para el espoligotipado, una metodología de genotipado muy cruda, el linaje 1 contiene las cepas de África Oriental - India (EAI), la familia Manila y algunas cepas de Manu (India); el linaje 2 es el grupo de Beijing ; el linaje 3 incluye las cepas de Asia Central (CAS); el linaje 4 incluye las cepas Ghana y Haarlem (H / T), América Latina - Mediterráneo (LAM) y X; los tipos 5 y 6 corresponden a M. africanum y se observan predominantemente y con alta frecuencia en África Occidental . Se ha aislado un séptimo tipo en el Cuerno de África. Las otras especies de este complejo pertenecen a varios espoligotipos y normalmente no infectan a los seres humanos.
Los linajes 2, 3 y 4 comparten un evento de deleción único (tbD1) y, por lo tanto, forman un grupo monofilético. Los tipos 5 y 6 están estrechamente relacionados con las cepas animales de MTBC, que normalmente no infectan a los humanos. El linaje 3 se ha dividido en dos clados: CAS-Kili (que se encuentra en Tanzania ) y CAS-Delhi (que se encuentra en India y Arabia Saudita ).
El linaje 4 también se conoce como linaje euroamericano. Los subtipos dentro de este tipo incluyen el Mediterráneo latinoamericano, Uganda I, Uganda II, Haarlem, X y Congo.
Un estudio muy citado informó que M. tuberculosis ha evolucionado conjuntamente con poblaciones humanas, y que el ancestro común más reciente del complejo M. tuberculosis evolucionó hace entre 40.000 y 70.000 años. Sin embargo, un estudio posterior que incluyó secuencias del genoma de miembros del complejo M. tuberculosis extraídas de tres momias peruanas de 1000 años de antigüedad, llegó a conclusiones bastante diferentes. Si el ancestro común más reciente del complejo M. tuberculosis tuviera entre 40 000 y 70 000 años, esto requeriría una tasa evolutiva mucho más baja que cualquier estimación producida por análisis genómicos de muestras heterocrónicas.
Un análisis de más de 3000 cepas de M. bovis de 35 países sugirió un origen africano para esta especie.
Co-evolución con los humanos modernos
Actualmente existen dos narrativas en paralelo sobre la era de MTBC y cómo se ha extendido y coevolucionado con los humanos a lo largo del tiempo. Un estudio comparó la filogenia de M. tuberculosis con la filogenia del genoma mitocondrial humano y los interpretó como muy similares. Basado en esto, el estudio sugirió que M. tuberculosis , al igual que los humanos, evolucionó en África y posteriormente se extendió con humanos anatómicamente modernos fuera de África en todo el mundo. Al calibrar la tasa de mutación de M. tuberculosis para que coincida con esta narrativa, el estudio sugirió que MTBC evolucionó hace 40.000 a 70.000 años. Aplicando esta escala de tiempo, el estudio encontró que el tamaño de la población efectiva de M. tuberculosis se expandió durante la Transición Demográfica Neolítica (hace alrededor de 10,000 años) y sugirió que M. tuberculosis pudo adaptarse a las poblaciones humanas cambiantes y que el éxito histórico de este patógeno fue impulsada, al menos en parte, por aumentos dramáticos en la densidad de la población de huéspedes humanos. También se ha demostrado que después de emigrar de un continente a otro, la región de origen de un huésped humano predice qué linaje de TB porta, lo que podría reflejar una asociación estable entre las poblaciones del huésped y linajes específicos de M. tuberculosis y / o interacciones sociales. que están moldeados por historias culturales y geográficas compartidas.
Con respecto a la congruencia entre las filogenias humana y de M. tuberculosis , un estudio que se basó en las secuencias de ADN del cromosoma Y humano y de M. tuberculosis para evaluar formalmente la correlación entre ellas, concluyó que no son congruentes. Además, un estudio más reciente que incluyó secuencias del genoma de miembros del complejo M. tuberculosis extraídas de tres momias peruanas de 1.000 años de antigüedad, estimó que el ancestro común más reciente del complejo M. tuberculosis vivió hace sólo 4.000 - 6.000 años. La tasa de evolución de M. tuberculosis estimada por Bos et al. El estudio también está respaldado por un estudio sobre Lineage 4 que se basa en secuencias genómicas de ADNc de momias húngaras de más de 200 años. En total, la evidencia favorece esta estimación más reciente de la edad del ancestro común más reciente de MTBC y, por lo tanto, la evolución global y la dispersión de M. tuberculosis se han producido durante los últimos 4 000 a 6 000 años.
Entre los siete linajes reconocidos de M. tuberculosis , solo dos son verdaderamente globales en su distribución: los linajes 2 y 4. Entre estos, el linaje 4 es el más disperso y domina casi por completo en las Américas. Se demostró que el linaje 4 evolucionó en Europa o en sus alrededores, y se extendió a nivel mundial con los europeos a partir del siglo XIII. Este estudio también encontró que la tuberculosis Lineage 4 se extendió a las Américas poco después del descubrimiento europeo del continente en 1492, y sugiere que esto representó la primera introducción de TB humana en el continente (aunque se han encontrado cepas de animales en restos humanos anteriores a Colón. De manera similar, se descubrió que Lineage 4 se extendió de Europa a África durante la Era de los Descubrimientos , comenzando a principios del siglo XV.
Se ha sugerido que las micobacterias ancestrales pueden haber infectado a los primeros homínidos en África Oriental ya hace tres millones de años.
Los fragmentos de ADN de M. tuberculosis y las indicaciones de la enfermedad de la tuberculosis estaban presentes en cuerpos humanos que datan de hace 9250-8160 años encontrados en Atlit-Yam en el Levante .
Resistencia a antibióticos (ABR)
M. tuberculosis es un organismo clonal y no intercambia ADN a través de la transferencia horizontal de genes . Esto, posiblemente combinado con una tasa de evolución relativamente baja, podría explicar por qué la evolución de la resistencia ha sido relativamente lenta en la especie en comparación con otros patógenos bacterianos importantes. Sin embargo, ABR es un desafío muy serio y creciente. Los más afectados son los países de las ex repúblicas soviéticas, donde ABR evolucionó y se extendió a niveles explosivos tras la caída de la Unión Soviética. Un ejemplo extremo es Bielorrusia, donde un tercio de todos los casos nuevos de tuberculosis son multirresistentes. La tuberculosis multirresistente requiere un tratamiento prolongado con fármacos costosos y a menudo tóxicos, y el fracaso del tratamiento es común.
La tuberculosis multirresistente (MDR-TB) es causada por un organismo que es resistente al menos a la isoniazida y la rifampicina , los dos fármacos antituberculosos más potentes. Estos medicamentos se utilizan para tratar a todas las personas con tuberculosis. La mayoría de las personas con TB se curan mediante una rutina de medicación de medio año que se sigue estrictamente y que se proporciona a los pacientes con apoyo y supervisión. El uso inadecuado o incorrecto de medicamentos antimicrobianos, o la utilización de planes ineficaces de medicamentos y la interrupción inoportuna del tratamiento pueden causar resistencia a los medicamentos, que luego puede transmitirse, especialmente en entornos abarrotados como prisiones y hospitales. En 2016, se estima que 490,000 personas en todo el mundo desarrollaron MDR-TB, y 110,000 personas adicionales con TB resistente a la rifampicina también fueron elegibles para el tratamiento de MDR-TB. Los países con el mayor número de casos de TB-MDR (47% del total mundial) fueron China, India y la Federación de Rusia.
Los investigadores apoyados por subvenciones de los NIH y NIAID han probado la eficacia de los peptoides antimicrobianos contra las hebras de Mycobacterium tuberculosis resistentes a los antibióticos. Los peptoides antimicrobianos demuestran un mecanismo de acción inespecífico contra la membrana bacteriana, que se diferencia de los antibióticos de molécula pequeña que se unen a receptores específicos (y por lo tanto son susceptibles a mutaciones o alteraciones en la estructura bacteriana). Los resultados preliminares sugirieron una "actividad apreciable" contra las hebras bacterianas sensibles a los fármacos, lo que llevó a un llamado a realizar más investigaciones sobre la viabilidad de los peptoides como una nueva clase de fármacos tuberculicidas.
Genética del hospedador
Se considera que la naturaleza de la interacción huésped-patógeno entre humanos y M. tuberculosis tiene un componente genético. Se observó un grupo de trastornos raros llamados susceptibilidad mendeliana a enfermedades micobacterianas en un subconjunto de personas con un defecto genético que da como resultado una mayor susceptibilidad a la infección por micobacterias.
Los primeros estudios de casos y gemelos han indicado que los componentes genéticos son importantes en la susceptibilidad del huésped a M. tuberculosis . Estudios recientes de asociación de todo el genoma (GWAS) han identificado tres loci de riesgo genético, incluso en las posiciones 11p13 y 18q11. Como es común en GWAS, las variantes descubiertas tienen tamaños de efecto moderados.
Reparación de ADN
Como patógeno intracelular, M. tuberculosis está expuesto a una variedad de agresiones que dañan el ADN, principalmente de radicales antimicrobianos tóxicos generados por el huésped. La exposición a especies reactivas de oxígeno y / o especies reactivas de nitrógeno causa diferentes tipos de daños en el ADN, incluida la oxidación, depurinación, metilación y desaminación que pueden dar lugar a roturas de una o dos hebras (DSB).
La polimerasa DnaE2 está regulada al alza en M. tuberculosis por varios agentes que dañan el ADN, así como durante la infección de ratones. La pérdida de esta ADN polimerasa reduce la virulencia de M. tuberculosis en ratones. DnaE2 es una polimerasa reparadora de ADN de reparación propensa a errores que parece contribuir a la supervivencia de M. tuberculosis durante la infección.
Las dos vías principales empleadas en la reparación de DSB son la reparación recombinacional homóloga (HR) y la unión de extremos no homólogos (NHEJ). M. tuberculosis internalizada por macrófagos puede persistir si cualquiera de estas vías es defectuosa, pero se atenúa cuando ambas vías son defectuosas. Esto indica que la exposición intracelular de M. tuberculosis al oxígeno reactivo y / o especies de nitrógeno reactivo da como resultado la formación de DSB que son reparados por HR o NHEJ. Sin embargo, la deficiencia de reparación de DSB no parece afectar la virulencia de M. tuberculosis en modelos animales.
Historia
M. tuberculosis , entonces conocido como el " bacilo de la tuberculosis ", fue descrito por primera vez el 24 de marzo de 1882 por Robert Koch , quien posteriormente recibió el Premio Nobel de Fisiología o Medicina por este descubrimiento en 1905; la bacteria también se conoce como "bacilo de Koch".
M. tuberculosis ha existido a lo largo de la historia, pero el nombre ha cambiado con frecuencia a lo largo del tiempo. En 1720, sin embargo, la historia de la tuberculosis comenzó a tomar forma en lo que se conoce hoy; como describió el médico Benjamin Marten en su Teoría del consumo , la tuberculosis puede ser causada por pequeños seres vivos que se transmiten a través del aire a otros pacientes. Esta enfermedad transmitida por el aire es la enfermedad infecciosa más mortal en todo el mundo y afecta a casi 2 mil millones de personas en todo el mundo en la actualidad. M. tuberculosi s se transmite fácilmente por el aire al estornudar, toser o simplemente hablar. Una gota contaminada puede infectar a cualquier persona y puede contaminarse con M. tuberculosis . De este modo, pasan a formar parte de los 1.800 millones de personas en todo el mundo que actualmente luchan contra esta enfermedad.
Vacuna
La vacuna BCG (bacilo de Calmette-Guerin), que se derivó de M. bovis, ha tenido un éxito limitado en la prevención de la tuberculosis. Esta vacuna se usa en países que son notorios por tener casos de M. tuberculosis , por lo que no es una vacuna recomendada en los Estados Unidos debido al bajo riesgo de infección. Para recibir esta vacuna en los Estados Unidos, se requiere que un individuo pase por un proceso de consulta con un experto en M. tb y solo se le administra a aquellos que cumplen con los criterios específicos.
El BCG, según un artículo de Kyodo News (14 de abril de 2020) titulado "Vacuna contra la tuberculosis llamando la atención en la lucha contra el coronavirus" indica una posible correlación entre la vacunación con BCG y una mejor respuesta inmune al COVID-19.
Ver también
Referencias
enlaces externos
| Scholia tiene un perfil de tema para Mycobacterium tuberculosis . |