Cultivo de malaria - Malaria culture
El cultivo de la malaria es el método para hacer crecer los parásitos de la malaria fuera del cuerpo, es decir, en un ambiente ex vivo . Aunque los intentos de propagación de los parásitos fuera de los modelos humanos o animales se remontan a 1912, el éxito de los intentos iniciales se limitó a uno o solo unos pocos ciclos. El primer cultivo continuo exitoso se estableció en 1976. Las esperanzas iniciales de que el cultivo ex vivo conduciría rápidamente al descubrimiento de una vacuna eran prematuras. Sin embargo, se facilitó enormemente el desarrollo de nuevos medicamentos .
Método
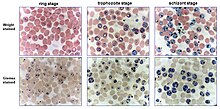
Los glóbulos rojos humanos infectados se incuban en una placa o matraz de cultivo a 37 ° C junto con un medio nutritivo y plasma , suero o sustitutos del suero. Una característica especial de la incubación es la mezcla de gas especial llena de nitrógeno (90-92%) CO 2 (5%) y oxígeno (3-5%) que permite que los parásitos crezcan a 37 ° C en una incubadora de células . Una alternativa a la gasificación de los cultivos con la mezcla de gases exacta es el uso de un frasco de vela. El frasco de vela es un recipiente hermético en el que se colocan los cultivos y una vela encendida . La vela encendida consume parte del oxígeno y produce dióxido de carbono (CO 2 ), que actúa como extintor de incendios . El contenido de dióxido de carbono en el aire fresco varía entre el 0,036% y el 0,039%. Una vez que la concentración de CO 2 alcanza aproximadamente el 5%, la vela deja de arder. El número de parásitos aumentó en un factor de 5 aproximadamente cada 48 horas (un ciclo). La parasitemia se puede determinar mediante frotis de sangre , para mantenerla dentro de los límites deseados, el cultivo se puede diluir con glóbulos rojos sanos.
El método original para la propagación exitosa ex vivo de P. falciparum describía el cultivo del parásito en condiciones estáticas (método de Trager-Jensen). James B. Jensen se incorporó al laboratorio de Trager como becario postdoctoral en 1976. Decidió emplear un frasco de vela en lugar de la incubadora de CO 2 . En el verano de 1976, Milton Friedman, un estudiante graduado del laboratorio de Trager que trabajaba en los laboratorios del MRC en Gambia , organizó el envío de una muestra de sangre humana infectada con P. falciparum a la ciudad de Nueva York. Este se diluyó con RPMI 1640 (que resultó ser el mejor de los medios comerciales) en placas de Petri , se colocó en un frasco de vela y se incubó. La línea creció muy bien y se convirtió en FCR-3 / Gambia, una de las cepas más utilizadas. Más tarde, se establecerían otras líneas utilizando métodos similares y el impacto del cultivo continuo de P. falciparum fue fenomenal, especialmente para la prueba de supuestos antipalúdicos y para descifrar sus genes. Varios informes posteriores (desde principios de la década de 1980) mostraron que la suspensión de células (usando una incubadora con agitación ) aumentaba significativamente el crecimiento del cultivo. También se ha demostrado que la agitación continua mejora otros parámetros de crecimiento de cultivos relevantes para los investigadores, como la prolongación de la sincronía de cultivos después de los procedimientos de sincronización y una reducción de la tasa de infecciones múltiples. A pesar de esto, la práctica de cultivar el parásito en condiciones estáticas sigue estando muy extendida. El mayor valor del método del frasco de vela es que se puede utilizar en laboratorios en casi cualquier lugar del mundo donde haya una incubadora, una vela y un desecador . Se puede obtener alrededor del 60% de células parasitadas utilizando condiciones de cultivo optimizadas. Estudios recientes de P. falciparum aislado directamente de pacientes infectados indican que ocurren estados biológicos de parásitos alternativos en el hospedador natural que no se observan con parásitos cultivados ex vivo .
Concentración de células infectadas
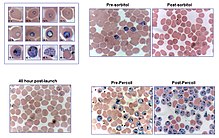
Para lograr la sincronización y / o concentración de los parásitos en cultivo se han desarrollado varios métodos. Se puede utilizar un procedimiento de gradiente de Percoll discontinuo para aislar los glóbulos rojos infectados porque los glóbulos rojos que contienen plasmodios son menos densos que los normales. Los trofozoítos jóvenes coincidieron con los eritrocitos en una banda ancha correspondiente a densidades de 1.075 a 1.100 g / ml, mientras que los esquizontes se concentraron a una densidad aproximada de 1.062 g / ml. Sin embargo, existen estudios que sugieren que algunas cepas de P. falciparum se ven afectadas en su capacidad de invasión después de haber sido expuestas a esta sustancia química. La diferencia entre la oxihemoglobina diamagnética de bajo espín en los glóbulos rojos no infectados y la hemozoína paramagnética en los glóbulos rojos infectados también se puede utilizar para el aislamiento. Las columnas magnéticas han demostrado ser menos dañinas para el parásito y son sencillas y ajustables a las necesidades del investigador. La columna se monta en un potente soporte de imán y el cultivo fluye a través de él. La columna atrapa los eritrocitos infectados con las últimas etapas de los parásitos, que luego pueden eluirse cuando la columna se retira del imán. Es un método simple que no necesita equipos costosos y no parece afectar a los parásitos en cuanto a su capacidad de invasión posterior.
Referencias
Otras lecturas
• Doolan, DL (Editor) (2002) Malaria Methods and Protocols (Methods in Molecular Medicine) , Totowa, NJ: Humana Press, ISBN 0-89603-823-8 / ISBN 978-0-89603-823-3