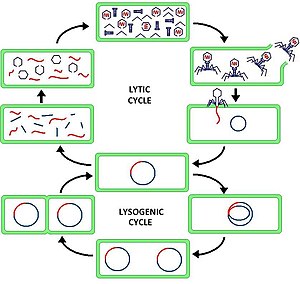
Ciclo lítico - Lytic cycle
El ciclo lítico ( / l ɪ t ɪ k / LIT -ik ) es uno de los dos ciclos de viral reproducción (en referencia a los virus bacterianos o bacteriófagos ), siendo el otro el ciclo lisogénico . El ciclo lítico da como resultado la destrucción de la célula infectada y su membrana. Los bacteriófagos que solo utilizan el ciclo lítico se denominan fagos virulentos (a diferencia de los fagos templados ).
En el ciclo lítico, el ADN viral existe como una molécula flotante libre separada dentro de la célula bacteriana y se replica por separado del ADN bacteriano del hospedador, mientras que en el ciclo lisogénico, el ADN viral se encuentra dentro del ADN del hospedador. Esta es la diferencia clave entre los ciclos de fagos lítico y lisogénico (bacterio). Sin embargo, en ambos casos el virus / fago se replica utilizando la maquinaria del ADN del huésped.
Descripción
El ciclo lítico, que también se conoce como el "ciclo reproductivo" del bacteriófago, es un ciclo de seis etapas. Las seis etapas son: adhesión, penetración, transcripción, biosíntesis, maduración y lisis.
- Accesorio : el fago se adhiere a la superficie de la célula huésped para inyectar su ADN en la célula.
- Penetración : el fago inyecta su ADN en la célula huésped al penetrar a través de la membrana celular.
- Transcripción : el ADN de la célula huésped se degrada y el metabolismo de la célula se dirige para iniciar la biosíntesis de fagos.
- Biosíntesis : el ADN del fago se replica dentro de la célula, sintetizando nuevas proteínas y ADN del fago.
- Maduración : el material replicado se ensambla en fagos virales completamente formados (cada uno compuesto por una cabeza, una cola y fibras de la cola)
- Lisis : los fagos recién formados se liberan de la célula infectada (que a su vez se destruye en el proceso) para buscar nuevas células huésped para infectar.
Apego y penetración
Para infectar una célula huésped, el virus primero debe inyectar su propio ácido nucleico en la célula a través de la membrana plasmática y (si está presente) la pared celular. El virus lo hace adhiriéndose a un receptor en la superficie de la célula o por simple fuerza mecánica. La unión se debe a interacciones electrostáticas y está influenciada por el pH y la presencia de iones. Luego, el virus libera su material genético (ya sea ARN o ADN monocatenario o bicatenario ) en la célula. En algunos virus, este material genético es circular e imita un plásmido bacteriano . En esta etapa, la célula se infecta y también puede ser atacada por el sistema inmunológico. En su mayoría, es ayudado por receptores en la superficie de la célula.
Transcripción y biosíntesis
Durante las etapas de transcripción y biosíntesis, el virus secuestra los mecanismos de replicación y traducción de la célula, usándolos para producir más virus. El ácido nucleico del virus utiliza la maquinaria metabólica de la célula huésped para producir grandes cantidades de componentes virales.
En el caso de los virus de ADN, el ADN se transcribe a sí mismo en moléculas de ARN mensajero (ARNm) que luego se utilizan para dirigir los ribosomas de la célula. Uno de los primeros polipéptidos que se traduce destruye el ADN del huésped. En los retrovirus (que inyectan una cadena de ARN), una enzima única llamada transcriptasa inversa transcribe el ARN viral en ADN, que luego se transcribe nuevamente en ARN. Una vez que el ADN viral ha tomado el control, induce a la maquinaria de la célula huésped a sintetizar ADN viral, proteína y comienza a multiplicarse.
La biosíntesis se regula (por ejemplo, T4 ) en tres fases de producción de ARNm seguidas de una fase de producción de proteínas.
- Fase temprana
- Las enzimas modifican el proceso de transcripción del huésped mediante la ARN polimerasa . Entre otras modificaciones, el virus T4 cambia el factor sigma del huésped produciendo un factor anti-sigma de modo que los promotores del huésped ya no se reconocen pero ahora reconocen las proteínas medias T4. Para la síntesis de proteínas , la subsecuencia de Shine-Dalgarno, GAGG, domina una traducción de genes temprana.
- Fase media
- Ácido nucleico del virus (ADN o ARN según el tipo de virus).
- Fase tardía
- Proteínas estructurales, incluidas las de la cabeza y la cola.
Maduración y lisis
Aproximadamente 25 minutos después de la infección inicial, se forman aproximadamente 200 nuevos viriones (cuerpos virales). Una vez que han madurado y acumulado suficientes viriones, se utilizan proteínas virales especializadas para disolver la pared celular. La célula estalla (es decir, sufre lisis ) debido a la alta presión osmótica interna (presión del agua) que ya no puede ser restringida por la pared celular. Esto libera viriones de la progenie en el entorno circundante, donde pueden infectar otras células y comienza otro ciclo lítico. El fago que causa la lisis del hospedador se llama fago lítico o virulento.
Bioquímica de regulación genética
Hay tres clases de genes en el genoma del fago que regulan si surgirán los ciclos lítico o lisogénico. La primera clase son los genes tempranos inmediatos, la segunda son los genes tempranos retardados y la tercera son los genes tardíos. Lo siguiente se refiere al fago lambda templado bien estudiado de E. coli.
- Genes tempranos inmediatos: Estos genes se expresan a partir de promotores reconocidos por la ARN polimerasa del huésped, e incluyen Cro , cII , y N . CII es un factor de transcripción que estimula la expresión del principal gen represor lisogénico, cI , mientras que Cro es un represor de la expresión de cI . La decisión de lisis-lisogenia está influenciada principalmente por la competencia entre Cro y CII, lo que da como resultado la determinación de si se produce o no suficiente represor de CI. Si es así, CI reprime los promotores tempranos y la infección se desvía hacia la vía lisogénica. N es un factor anti-terminación que se necesita para la transcripción de los genes tempranos retardados.
- Genes tempranos retardados: estos incluyen los genes de replicación O y P y también Q , que codifica el anti-terminador responsable de la transcripción de todos los genes tardíos.
- Genes tardíos:
La activación de la transcripción tardía mediada por Q comienza alrededor de 6 a 8 min después de la infección si se elige la vía lítica. Más de 25 genes se expresan a partir del único promotor tardío, lo que da como resultado cuatro rutas biosintéticas paralelas. Tres de las vías son para la producción de los tres componentes del virión: la cabeza llena de ADN, la cola y las fibras laterales de la cola. Los viriones se autoensamblan a partir de estos componentes y el primer virión aparece aproximadamente 20 minutos después de la infección. La cuarta vía es la lisis. En lambda 5 las proteínas están involucradas en la lisis: la holina y antiholina del gen S , la endolisina del gen R y las proteínas spanina de los genes Rz y Rz1 . En lambda de tipo salvaje, la lisis ocurre aproximadamente a los 50 min, liberando aproximadamente 100 viriones completos. El momento de la lisis está determinado por las proteínas holina y antiholina, y la última inhibe a la primera. En resumen, la proteína holina se acumula en la membrana citoplasmática hasta que de repente se forman agujeros a escala micrométrica, lo que desencadena la lisis. La endolisina R se libera al periplasma, donde ataca al peptidoglicano. Las proteínas spanina Rz y Rz1 se acumulan en las membranas citoplasmática y externa, respectivamente, y forman un complejo que atraviesa el periplasma a través de la red del peptidoglicano. Cuando la endolisina degrada el peptidoglicano, los complejos de spanina se liberan y provocan la rotura de la membrana externa. La destrucción del peptidoglicano por la endolisina y la rotura de la membrana externa por el complejo de spanina son ambas necesarias para la lisis en las infecciones lambda.
Inhibición de la lisis: los fagos similares a T4 tienen dos genes, rI y rIII , que inhiben la holina T4, si la célula infectada sufre una superinfección por otro virión T4 (o estrechamente relacionado). La sobreinfección repetida puede hacer que la infección por T4 continúe sin lisis durante horas, lo que lleva a la acumulación de viriones a niveles 10 veces más altos de lo normal.