Linfangioleiomiomatosis - Lymphangioleiomyomatosis
| Linfangioleiomiomatosis (LAM) | |
|---|---|
| Otros nombres | linfangiomiomatosis, LAM |
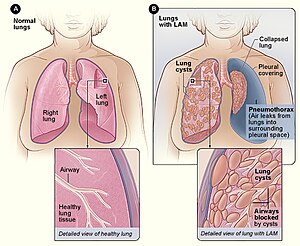 | |
| La figura A muestra la ubicación de los pulmones y las vías respiratorias en el cuerpo. La imagen insertada muestra una sección transversal de un pulmón sano. La figura B muestra una vista de los pulmones con LAM y un pulmón colapsado ( neumotórax ). La imagen insertada muestra una sección transversal de un pulmón con LAM. | |
| Especialidad |
Neumología |
La linfangioleiomiomatosis ( LAM ) es una enfermedad poco común, progresiva y sistémica que generalmente resulta en la destrucción quística del pulmón . Afecta predominantemente a las mujeres, especialmente durante la edad fértil. El término LAM esporádico se usa para pacientes con LAM no asociado con el complejo de esclerosis tuberosa (TSC), mientras que TSC-LAM se refiere a LAM que está asociado con TSC.
Signos y síntomas
La edad promedio de aparición es entre los 30 y los 30 años. Se ha informado de disnea de esfuerzo (dificultad para respirar) y neumotórax espontáneo (colapso pulmonar) como la presentación inicial de la enfermedad en el 49% y el 46% de los pacientes, respectivamente.
El diagnóstico suele retrasarse de 5 a 6 años. La afección a menudo se diagnostica erróneamente como asma o enfermedad pulmonar obstructiva crónica . El primer neumotórax , o colapso pulmonar, precede al diagnóstico de LAM en el 82% de los pacientes. La definición clínica de consenso de LAM incluye múltiples síntomas:
- Fatiga
- Tos
- Tos con sangre (rara vez masiva)
- Dolor de pecho
- Complicaciones quilosas derivadas de la obstrucción linfática, que incluyen
- Quilotórax
- Ascitis quilosa
- Quilopericardio
- Quiloptisis
- Quiluria
- Quilo en flujo vaginal
- Quilo en las heces.
- Los angiomiolipomas (tumores de riñón graso) están presentes en aproximadamente el 30% de los pacientes con LAM esporádico y hasta el 90% de los pacientes con TSC-LAM. Los angiomiolipomas a veces pueden sangrar espontáneamente y causar dolor o presión arterial baja .
- En el retroperitoneo, la pelvis o el mediastino pueden aparecer linfangiomas quísticos o ganglios linfáticos con centros hipodensos, que imitan linfomas necrotizantes, cánceres de ovario o renales u otras neoplasias malignas.
La destrucción pulmonar en LAM es una consecuencia de la infiltración difusa por células neoplásicas parecidas al músculo liso que invaden todas las estructuras pulmonares, incluidos los linfáticos , las paredes de las vías respiratorias, los vasos sanguíneos y los espacios intersticiales . Las consecuencias de la obstrucción de los vasos y las vías respiratorias incluyen acumulación de líquido quiloso, hemoptisis , obstrucción del flujo de aire y neumotórax . El curso típico de la enfermedad muestra disnea progresiva de esfuerzo, espaciada por neumotórax recurrentes y, en algunos pacientes, derrames pleurales quilosos o ascitis.
La mayoría de las personas presentan disnea de esfuerzo con las actividades diarias 10 años después de la aparición de los síntomas. Muchos pacientes requieren oxígeno suplementario durante ese intervalo.
Genética
El LAM se presenta en dos situaciones: en la enfermedad del complejo de esclerosis tuberosa (TSC-LAM) y de forma esporádica, en mujeres que no tienen TSC (LAM esporádico). En ambos entornos, la evidencia genética indica que el LAM es causado por mutaciones inactivadoras o de "pérdida de función" en los genes TSC1 o TSC2, que fueron clonados en 1997 y 1993 respectivamente. El gen TSC1 está ubicado en el brazo largo del cromosoma 9 (9q34) y el gen TSC2 está ubicado en el brazo corto del cromosoma 16 (16p13). TSC-LAM ocurre en mujeres que tienen mutaciones de la línea germinal en el gen TSC1 o TSC2.
El LAM esporádico se asocia principalmente con mutaciones del gen TSC2 somático. Las mutaciones somáticas y de la línea germinal en LAM incluyen muchos tipos de mutaciones diseminadas a través de los genes, sin “puntos calientes” claros, que incluyen cambios sin sentido, deleciones en marco y mutaciones sin sentido. Debido al gran tamaño de los genes (juntos tienen más de 60 exones) y debido a que las mutaciones pueden ubicarse prácticamente en cualquier lugar dentro de los genes, la detección de mutaciones a menudo es un desafío.
Sobre una base celular, células LAM llevan bi-alélica inactivación de los genes TSC2, consistente con el modelo gen supresor de tumor “de dos hit”. El segundo evento de impacto en las células LAM es a menudo la pérdida de la región cromosómica que contiene la copia de tipo salvaje del gen TSC2; esto se conoce como pérdida de heterocigosidad o LOH. La LOH se puede detectar en células LAM microdiseccionadas, en angiomiolipomas y ganglios linfáticos de mujeres con LAM y en células LAM circulantes (células en sangre y orina).
Los angiomiolipomas y las células LAM pulmonares de mujeres con la forma esporádica de LAM portan mutaciones idénticas en TSC2. Esto, junto con el hecho de que el LAM recurrente después del trasplante de pulmón porta las mismas mutaciones de TSC2 que el LAM original, ha llevado a la hipótesis de la "metástasis benigna" de que las células LAM pueden migrar o hacer metástasis de un sitio a otro.
Fisiopatología
Un porcentaje variable de células dentro de la lesión LAM contiene inactivación mutacional de los genes supresores de tumores del Complejo de Esclerosis Tuberosa (TSC1 o TSC2). Las mutaciones de TSC1 causan un fenotipo clínico menos grave que las mutaciones de TSC2. El descubrimiento de la función del gen TSC1 / 2 como regulador negativo de la diana de mamíferos del complejo de rapamicina 1 (mTORC1) condujo al uso exitoso del sirolimus análogo de rapamicina en ensayos clínicos y a la aprobación de sirolimus por la FDA para el tratamiento de LAM.
TSC1 y TSC2 forman un complejo supresor de tumores que regula el complejo de señalización de la diana de rapamicina (mTOR) en mamíferos controlando directamente la actividad de la pequeña GTPasa Rheb a través del dominio de la proteína activadora de GTPasa (GAP) de TSC2. Rheb se une a Raptor y controla la actividad del complejo mTOR 1 (mTORC1) que fosforila directamente la quinasa p70 S6 (S6K1) y 4E-BP1. mTOR forma dos complejos multiproteicos física y funcionalmente distintos: el mTORC1 sensible a rapamicina y el mTORC2 insensible a rapamicina. MTORC1 consta de cinco proteínas, incluida Raptor, que regulan positivamente la actividad de mTOR. MTORC2 consta de seis proteínas que incluyen mTOR y Rictor , que define el nivel de activación de mTORC2 y modula el ensamblaje del citoesqueleto de actina a través de Rho GTPasas, y se requiere Rac1 para la activación de mTOR. En células LAM humanas y nulas para TSC2, la actividad Rho GTPasa es necesaria para la adhesión, motilidad, proliferación y supervivencia celular. La pérdida de TSC1 / TSC2 en LAM induce el crecimiento incontrolado de células LAM y aumenta la viabilidad de las células LAM. La regulación al alza de STAT1 y STAT3 y la autofagia son mediadores conocidos de la viabilidad y supervivencia de las células LAM.
Las células LAM se comportan, de muchas formas, como células tumorales metastásicas . Las células LAM parecen surgir de una fuente extrapulmonar y migrar al pulmón. La reexpresión de TSC2 rescata el aumento de la migración e invasividad de células LAM. Los mecanismos celulares y moleculares de la transformación neoplásica y la destrucción del parénquima pulmonar por las células LAM siguen siendo desconocidos. La remodelación pulmonar puede estar mediada por un desequilibrio entre las metaloproteinasas que degradan la matriz (MMP) y sus inhibidores endógenos TIMP. El fenotipo celular invasivo en LAM está asociado con la regulación a la baja de TIMP-3 y la regulación al alza de MMP dependiente de TSC2.
La evidencia clínica e histopatológica demuestra la afectación linfática en LAM. La hipótesis predominante es que las lesiones de LAM secretan el factor linfangiogénico VEGF- D, reclutan células endoteliales linfáticas (LEC) que forman vasos linfáticos e inducen quistes pulmonares. Los niveles séricos de VEGF-D aumentan en LAM en comparación con otras enfermedades pulmonares quísticas, incluida la histiocitosis pulmonar de células de Langerhans , enfisema, síndrome de Sjögren o síndrome de Birt-Hogg-Dubé . Los niveles de VEGF-D se correlacionan con la gravedad del LAM, evaluado como una medida del grado de CT (la abundancia de derrames quilosos y compromiso linfático). VEGF-D es una glicoproteína homodimérica secretada y un miembro de la familia VEGF de factores de crecimiento, es conocido por su papel en la linfangiogénesis y metástasis del cáncer . El procesamiento proteolítico de VEGF-D afecta la unión análoga a VEGFR3. Histopatológicamente, las lesiones de LAM están rodeadas por células que se tiñen para VEGFR 3, el receptor de hialuronano endotelial 1 del vaso linfático (LYVE-1) y podoplanina . VEGF-D se une a las proteínas tirosina quinasas receptoras VEGFR-2 y VEGFR-349 en humanos y a VEGFR3 en ratones. Sorprendentemente, la eliminación de VEGF-D en ratones tiene poco efecto sobre el desarrollo del sistema linfático. No obstante, durante la tumorigénesis, el VEGF-D promueve la formación de vasos linfáticos tumorales y facilita la diseminación metastásica de las células cancerosas. Sin embargo, se sabe poco sobre el papel de los linfáticos anormales y VEGF-D en la patogénesis de LAM .
Diagnóstico
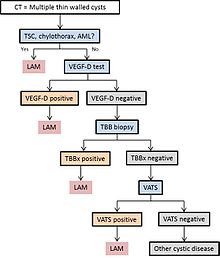
LAM puede recibir atención médica de varias maneras, la mayoría de las cuales desencadenan una tomografía computarizada de tórax. El cambio quístico de pared delgada en los pulmones se puede encontrar incidentalmente en las tomografías computarizadas del corazón, el tórax o el abdomen (en los cortes que incluyen las bases pulmonares) obtenidas para otros fines. La TCAR de pacientes con CET revela que alrededor del 20% de las mujeres tienen cambios quísticos a los 20 años y alrededor del 80% de las mujeres tienen cambios quísticos después de los 40 años. La TAC de tórax a veces revela LAM en pacientes que presentan un neumotórax espontáneo primario aparente, pero más a menudo, la exploración por TC no se ordena (en los Estados Unidos) hasta que ocurren las recurrencias. La disnea progresiva de esfuerzo sin las exacerbaciones y remisiones que son características del asma o la EPOC a veces provocan una TC de tórax. Una revisión de la TC por parte de un experto familiarizado con LAM puede aumentar la precisión del diagnóstico. El quilotórax también puede llamar la atención sobre LAM.
En algunos casos, se puede hacer un diagnóstico de LAM con confianza por motivos clínicos (sin biopsia ) en pacientes con cambios quísticos típicos en la tomografía computarizada de alta resolución del pulmón y hallazgos de esclerosis tuberosa, angiomiolipoma , linfangioleiomioma, quilotórax o VEGF-D sérico> 800 pg / ml.
Si no se presenta ninguna de estas características clínicas, puede ser necesaria una biopsia para hacer el diagnóstico. La biopsia pulmonar por videotoracoscopia es la técnica más definitiva, pero la biopsia transbronquial tiene un rendimiento superior al 50% y también puede ser eficaz. Sin embargo, la seguridad de este último procedimiento en pacientes con enfermedad quística difusa y la profusión de cambios quísticos que predice una biopsia informativa no se comprenden completamente, sin embargo. La citología de líquidos quilosos, ganglios abdominales aspirados o masas linfáticas también puede ser diagnóstica.
El diagrama 1 describe un algoritmo propuesto para el diagnóstico de LAM.
Radiografía de tórax
La radiografía de tórax puede parecer relativamente normal, incluso al final de la enfermedad, o puede sugerir hiperinsuflación solamente. A medida que avanza la enfermedad, la radiografía de tórax a menudo muestra opacidades reticulonodulares difusas, bilaterales y simétricas, quistes, ampollas o apariencia de "panal de abeja" (es decir, pseudo fibrótica). Puede ser evidente el derrame pleural y el neumotórax . La preservación de los volúmenes pulmonares en presencia de un aumento de las marcas intersticiales es una característica radiográfica del LAM que ayuda a distinguirlo de la mayoría de las otras enfermedades pulmonares intersticiales, en las que la expansión del tabique alveolar e intersticial tienden a aumentar las propiedades de retroceso elástico del pulmón y la disminución de los volúmenes pulmonares.
Tomografía computarizada
La tomografía computarizada de alta resolución (TCAR) de tórax es mejor que la radiografía de tórax para detectar enfermedad parenquimatosa quística y casi siempre es anormal en el momento del diagnóstico, incluso cuando la radiografía de tórax y las evaluaciones de la función pulmonar son normales. La TC típica muestra quistes redondos difusos, bilaterales, de paredes delgadas de tamaños variables que van desde 1 a 45 mm de diámetro. El número de quistes varía en LAM desde unos pocos hasta el reemplazo casi completo del tejido pulmonar normal. La profusión de quistes tiende a ser más leve en pacientes con TSC-LAM que con S-LAM, tal vez explicado en parte porque los pacientes con TSC-LAM generalmente reciben un cribado más temprano. Los derrames pleurales se observan en la TC en el 12% de los pacientes con S-LAM y en el 6% de los pacientes con TSC-LAM. Otras características de la TC incluyen densidades lineales (29%), linfadenopatía hiliar o mediastínica (9%), neumotórax, linfangiomioma y dilatación del conducto torácico. Las opacidades en vidrio deslustrado (12%) sugieren la presencia de edema intersticial por congestión linfática. En pacientes con CET, las densidades nodulares en la TCAR pueden representar hiperplasia de neumocitos micronodular multifocal (MMPH) formada por grupos de neumocitos hiperplásicos de tipo II. MMPH puede estar presente en hombres o mujeres con TSC en presencia o ausencia de LAM, pero no en pacientes con S-LAM. La MMPH no se asocia típicamente con consecuencias fisiológicas o pronósticas, pero se ha informado un caso de insuficiencia respiratoria debido a MMPH.
Exploraciones de ventilación-perfusión
En un estudio , las exploraciones de ventilación-perfusión fueron anormales en 34 de 35 pacientes con LAM. La anomalía más común fue la heterogeneidad difusa inespecífica , generalmente muy parecida. Estos autores también describieron un "patrón de moteado" "inusual" en las imágenes de perfusión en el 74% de los pacientes, que consiste en "colecciones pequeñas, a menudo periféricas, de radioisótopos".
Tomografía de emisión de positrones
Las lesiones de LAM y AML no suelen mostrar un aumento de la captación de 18F-fluorodesoxiglucosa en la tomografía por emisión de positrones (PET). Por lo tanto, se deben considerar otras neoplasias (o fuentes de inflamación) en los casos de LAM conocidos o sospechados en los que los resultados de la FDG-PET son positivos.
Imagen abdominal
Las anomalías en las imágenes abdominales, como la LMA renal y el agrandamiento de las estructuras linfáticas, también son frecuentes en la LAM. La densidad de grasa dentro de una masa renal es patognomónica de AML. Las AML son más prevalentes y con mayor frecuencia bilaterales y grandes en pacientes con TSC-LAM que en pacientes con S-LAM. El tamaño de la LMA se correlaciona con la prevalencia de quistes pulmonares en pacientes con CET. Un estudio de TC tomó imágenes de 256 pacientes con S-LAM y 67 con TSC-LAM. Los AML renales estuvieron presentes en el 32% de los pacientes con S-LAM y en el 93% de los pacientes con TSC-LAM. Las AML hepáticas estuvieron presentes en el 2% de los pacientes con S-LAM y en el 33% de los pacientes con TSC-LAM. La ascitis fue poco común, se observó en menos del 10% de los pacientes con LAM. La linfangiomatosis abdominal, que a menudo contiene componentes quísticos y sólidos, se observó en el 29% de los pacientes con S-LAM y en el 9% de los pacientes con TSC-LAM.
Imágenes del sistema nervioso central
Las anomalías del sistema nervioso central, como los tubérculos corticales o subependimarios y los astrocitomas , son frecuentes en pacientes con TSC, incluidos aquellos con TSC-LAM, pero no se encuentran en mujeres con S-LAM. Moss y colaboradores informaron que las mujeres con S-LAM y TSC-LAM pueden tener una mayor incidencia de meningioma , pero se ha cuestionado la importancia de ese hallazgo.
Estudios de función pulmonar
Las pruebas de función pulmonar en pacientes con LAM pueden ser normales o pueden revelar patrones obstructivos, restrictivos o mixtos. La fisiología obstructiva es la anomalía más común. Los datos de función pulmonar con control de calidad fueron recopilados prospectivamente por el Registro NHLBI, un estudio de 5 años de pacientes con LAM en centros de los Estados Unidos. La espirometría reveló cambios obstructivos en aproximadamente el 57% de los pacientes y resultados normales en el 34%. La restricción, definida como una capacidad pulmonar total menor que el límite inferior de lo normal, se observó en el 11%. La hiperinflación estuvo presente en aproximadamente el 6%. El volumen residual promedio fue el 125% del predicho cuando se midió por pletismografía, pero fue sólo el 103% del predicho determinado con métodos de dilución de gas, lo que sugiere un atrapamiento de aire significativo en espacios aéreos no comunicantes. Aproximadamente el 25% de los pacientes con fisiología obstructiva pueden demostrar capacidad de respuesta a los broncodilatadores, pero pueden ser menores en la obstrucción más grave. El defecto fisiológico obstructivo en LAM se atribuye principalmente a la obstrucción del flujo de aire. El cambio más temprano en la prueba de función pulmonar inicial en varias series de casos fue la transferencia anormal de gas, evaluada por la capacidad de difusión del monóxido de carbono (DLCO), descrita en 82% a 97% de los pacientes. No es inusual que la DLCO se reduzca desproporcionadamente con el volumen espiratorio forzado en 1 segundo (FEV1). En general, se considera que la reducción de DLCO y el aumento del volumen residual son las manifestaciones fisiológicas más tempranas de LAM.
La prueba de esfuerzo cardiopulmonar en una cohorte mucho más grande de pacientes con LAM reveló un consumo máximo de oxígeno ( VO 2 máx. ) Y un umbral anaeróbico reducido en 217 pacientes. Se encontró hipoxemia inducida por el ejercicio incluso en pacientes que no tenían anomalías en reposo en el FEV1 y DLCO. En la mayoría de los pacientes, se pensó que el ejercicio estaba limitado por la ventilación, debido a la obstrucción del flujo de aire y al aumento de la ventilación del espacio muerto.
La progresión de la enfermedad suele ir acompañada de un defecto ventilatorio obstructivo progresivo. La disminución del FEV1 es el parámetro más utilizado para controlar la progresión de la enfermedad. Aunque la hipertensión pulmonar en reposo parece ser inusual en LAM, la presión arterial pulmonar a menudo aumenta con niveles bajos de ejercicio, relacionado en parte con hipoxemia. Un estudio informó un aumento de las derivaciones intraparenquimatosas en pacientes disneicos con LAM, que puede contribuir a la hipoxemia en reposo y durante el ejercicio.
Patología
Macroscópicamente, los pulmones LAM están agrandados y difusamente quísticos, con espacios de aire dilatados de hasta varios centímetros de diámetro. El examen microscópico del pulmón revela focos de infiltración de células parecidas al músculo liso del parénquima pulmonar, las vías respiratorias, los vasos linfáticos y los vasos sanguíneos asociados con áreas de cambio quístico de paredes delgadas. Las lesiones de LAM a menudo contienen una gran cantidad de canales linfáticos, que forman una red anastomosa de espacios en forma de hendidura revestidos por células endoteliales . Las células LAM generalmente expanden los espacios intersticiales sin violar los planos tisulares, pero se ha observado que invaden las vías respiratorias, la arteria pulmonar, el diafragma, la aorta y la grasa retroperitoneal , destruyen el cartílago bronquial y las paredes arteriolares y ocluyen la luz de las arteriolas pulmonares.
Hay dos morfologías celulares principales en la lesión de LAM: células pequeñas en forma de huso y células epitelioides cuboidales. Las células LAM se tiñen positivamente para los receptores de actina , vimentina , desmina y, a menudo, de estrógeno y progesterona del músculo liso . Las células cuboideas dentro de las lesiones de LAM también reaccionan con un anticuerpo monoclonal llamado HMB-45, desarrollado contra la proteína premelanosomal gp100, una enzima en la vía de la melanogénesis. Este marcador inmunohistoquímico es muy útil para el diagnóstico, porque otras lesiones pulmonares predominantes en el músculo liso no reaccionan con el anticuerpo. Las células fusiformes de la lesión de LAM son más frecuentemente positivas para el antígeno nuclear celular proliferante que las células cuboidales, lo que concuerda con un fenotipo proliferativo. En comparación con las células musculares lisas normales en forma de cigarro, las células LAM fusiformes contienen citoplasma menos abundante y son menos eosinofílicas. Los receptores de estrógeno y progesterona también están presentes en las lesiones de LAM, pero no en el tejido pulmonar normal adyacente. Las lesiones de LAM expresan marcadores linfáticos LYVE-1, PROX1, podoplanina y VEGFR-3. Las células parecidas al músculo liso de las LMA son morfológica e inmunohistoquímicamente similares a las células LAM, incluida la reactividad con anticuerpos dirigidos contra actina, desmina, vimentina y HMB-45, así como receptores de estrógeno y progesterona. A diferencia de los espacios aéreos dilatados en el enfisema, los espacios quísticos que se encuentran en LAM pueden estar parcialmente revestidos con células hiperplásicas de tipo II.
Tratamiento
Un fármaco aprobado por la FDA para el tratamiento de LAM, el inhibidor de mTOR sirolimus , está disponible para estabilizar el deterioro de la función pulmonar. El trasplante de pulmón sigue siendo el último recurso para los pacientes con enfermedad avanzada.
Neumotórax
Los neumotórax en pacientes con LAM tienden a reaparecer, especialmente después de un manejo conservador como observación, aspiración o toracostomía con tubo simple. Más del 65% de los pacientes con LAM desarrollan neumotórax durante el curso de su enfermedad, con un promedio de 3,5 neumotórax en aquellos que tienen al menos un neumotórax. El Grupo de Consenso Pleural de la Fundación LAM abogó por el uso de un procedimiento de sínfisis pleural con el primer neumotórax, dada la probabilidad de recurrencia superior al 70%. La esclerosis química, la abrasión mecánica, el vertido de talco y la pleurectomía han sido eficaces en pacientes con LAM, pero se prefiere la abrasión mecánica para aquellos que pueden requerir un trasplante pulmonar en el futuro. Aproximadamente la mitad de los pacientes con LAM que se han sometido a un trasplante han tenido un procedimiento de pleurodesis previo , y más del 75% de ellos habían tenido pleurodesis bilateral previa . Aunque la pleurodesis no es una contraindicación para el trasplante, puede resultar en un aumento del sangrado perioperatorio.
Quilotórax
El quilo generalmente no causa inflamación pleural ni fibrosis. Los derrames quilosos estables pequeños rara vez requieren intervención una vez que se establece el diagnóstico de LAM. La dificultad para respirar puede exigir un drenaje posiblemente repetido. El sirolimus es eficaz para los derrames quilosos y la mayoría de los expertos creen que debe usarse como primera línea de tratamiento. Para los derrames refractarios se recomienda la obtención de imágenes de la fuente de la fuga con una resonancia magnética ponderada en T2 pesada o una linfangiografía de contraste. Algunas fugas son susceptibles de embolización a través de catéteres que van desde los ganglios linfáticos de la ingle hasta el conducto torácico . Se puede considerar la ligadura del conducto torácico, pero dado que los derrames torácicos a veces se originan por ascitis que son sifonadas hacia el tórax por la acción del fuelle del tórax, es importante descartar una fuente abdominal antes de considerar esta opción. Es posible que se requiera sínfisis pleural para prevenir deficiencias nutricionales y de linfocitos que pueden resultar de golpes repetidos o drenaje persistente. La pleurodesis química es generalmente una terapia eficaz para el quilotórax, al igual que la abrasión mecánica y el vertido de talco.
Angiomiolipoma
Los angiomiolipomas renales (AML) pueden requerir embolización o cauterización para controlar el sangrado, una complicación que se cree que es más común cuando el diámetro del tumor excede los 4 cm. La extensión del cambio aneurismático puede determinar el riesgo de hemorragia. Se deben realizar imágenes abdominales seriadas para evaluar el tamaño de la AML a intervalos de 6 a 12 meses, al menos hasta que las tendencias de crecimiento sean claras. Se pueden considerar resecciones parciales con conservación de nefrona para tumores muy grandes. En ocasiones, la nefrectomía se requiere para tumores con extensión intravascular u otras razones, pero rara vez es el método de elección para las LMA que pueden tratarse con métodos menos invasivos. Everolimus está aprobado por la Administración de Drogas y Alimentos de los Estados Unidos (FDA) para el tratamiento de la AML.
Linfangioleiomioma
Las linfangioleiomiomatosis son estructuras hipodensas llenas de líquido presentes en las regiones retroperitoneales del abdomen y la pelvis en aproximadamente el 30% de los pacientes con LAM. Por lo general, no requieren intervención. La biopsia o la resección pueden provocar una fuga prolongada. Los inhibidores de mTOR son eficaces para reducir el tamaño de la linfangioleiomiomatosis y pueden conducir a una resolución total.
Gestión-otro
Los medicamentos que contienen estrógenos pueden exacerbar la LAM y están contraindicados. No se ha demostrado que los agentes que antagonizan los efectos del estrógeno sean eficaces para el tratamiento, pero no se han realizado ensayos adecuados. Se debe considerar una prueba de broncodilatadores en pacientes con LAM, porque hasta 17% a 25% tienen obstrucción del flujo de aire que responde a broncodilatadores . Se debe administrar oxígeno para mantener las saturaciones de oxihemoglobina superiores al 90% con descanso, ejercicio y sueño. Se debe considerar la densitometría ósea en todos los pacientes que están inmovilizados y / o en tratamiento con antiestrógenos, y se debe instituir la terapia adecuada para los pacientes osteoporóticos . Se debe prestar la debida atención a la salud cardiovascular después de la menopausia natural o inducida . Las vacunas contra el neumococo y la influenza deben mantenerse actualizadas. La rehabilitación pulmonar parece ser particularmente gratificante en pacientes jóvenes motivados con enfermedad pulmonar obstructiva, pero no se han realizado estudios para evaluar el efecto de esta intervención sobre la tolerancia al ejercicio, el acondicionamiento y la calidad de vida.
Medicamento
Sirolimus es un inhibidor de mTOR que estabiliza la función pulmonar y mejora algunas medidas de vida en pacientes con LAM. Está aprobado por la FDA para su uso en LAM, según los resultados del ensayo Multicenter International LAM Efficacy and Safety of Sirolimus (MILES). Los datos de MILES apoyan el uso de sirolimus en pacientes que tienen una función pulmonar anormal (es decir, FEV1 <70% del pronóstico). No está claro si los beneficios del tratamiento superan los riesgos para los pacientes LAM asintomáticos con función pulmonar normal, pero algunos médicos consideran el tratamiento para pacientes en declive que se acercan al rango anormal del FEV1. El sirolimus también parece ser eficaz para el tratamiento de los derrames quilosos y la linfangioleiomiomatosis. Los beneficios del sirolimus solo persisten mientras continúa el tratamiento. No se ha estudiado la seguridad de la terapia a largo plazo.
Los posibles efectos secundarios de los inhibidores de mTOR incluyen hinchazón en los tobillos, acné, úlceras orales, dispepsia , diarrea, elevación del colesterol y triglicéridos , hipertensión y dolor de cabeza. La neumonitis por sirolimus y la neoplasia maligna latente son preocupaciones más graves, pero ocurren con poca frecuencia. Sirolimus inhibe la cicatrización de heridas. Es importante interrumpir el tratamiento con el fármaco durante 1 a 2 semanas antes y después de los procedimientos electivos que requieren una cicatrización óptima de la herida. Se deben tomar precauciones para evitar la exposición prolongada al sol debido al aumento del riesgo de cáncer de piel .
En un ensayo pequeño, abierto, se informó que el tratamiento con otro inhibidor de mTOR, everolimus , se asoció con una mejoría en el FEV1 y la distancia de caminata de seis minutos. Los niveles séricos de VEGF-D y colágeno IV se redujeron con el tratamiento. Los eventos adversos fueron generalmente consistentes con los que se sabe están asociados con los inhibidores de mTOR, aunque algunos fueron graves e incluyeron edema periférico , neumonía, insuficiencia cardíaca e infección por Pneumocystis jirovecii . Se utilizaron dosis crecientes de everolimus, hasta 10 mg por día; más alto de lo que se usa típicamente clínicamente para LAM.
La concentración sérica de VEGF-D es un biomarcador útil, predictivo y pronóstico. Los niveles de VEGF-D basales más altos predicen una progresión de la enfermedad más rápida y una respuesta al tratamiento más sólida.
Los enfoques hormonales para el tratamiento nunca se han probado en ensayos adecuados. En ausencia de un beneficio comprobado, no se recomienda habitualmente el tratamiento con progesterona , agonistas de GnRh (p. Ej., Leuprorelina , goserelina ) y tamoxifeno . La doxiciclina no tuvo ningún efecto sobre la tasa de disminución de la función pulmonar en un ensayo doble ciego.
El sirolimus suele ser eficaz como tratamiento de primera línea para el quilotórax. Si persisten las fugas o acumulaciones de quilo a pesar del tratamiento, se puede considerar la obtención de imágenes con resonancia magnética ponderada en T2 pesada, linfangiografía por resonancia magnética o linfangiografía del conducto torácico. Los procedimientos de fusión pleural pueden considerarse en casos refractarios.
Pronóstico
Las estimaciones de supervivencia varían, dependiendo del modo de presentación o verificación, y en general han tendido al alza, probablemente debido al reconocimiento más temprano a través del uso más generalizado de la tomografía computarizada. En una reciente encuesta de cohortes basada en la población, se encontró que la mediana de supervivencia era de 29 años. Los datos de grandes series de casos anteriores indicaron que entre el 38% y el 78% de los pacientes estaban vivos a los 8,5 años desde el inicio de la enfermedad.
Los pacientes suelen desarrollar una obstrucción progresiva del flujo de aire. En una cohorte de pacientes en el Reino Unido, 10 años después de la aparición de los síntomas, el 55% de 77 pacientes estaban sin aliento caminando sobre un terreno plano y el 10% estaban confinados en casa. La tasa promedio anual de disminución del FEV1 y DLCO en 275 pacientes estudiados en un único laboratorio de función pulmonar en el NHLBI fue de 75 ± 9 ml y 0,69 ± 0,07 ml / min / mm Hg, respectivamente. En otras series de Europa, la tasa de disminución del FEV1 fue considerablemente mayor, estimada en aproximadamente 100 a 120 ml / año. En el ensayo MILES, los pacientes del grupo placebo perdieron 134 cc / año. En estos estudios hubo alguna evidencia de que la tasa de disminución de la función pulmonar se correlaciona con la DLCO inicial, con el estado menopáusico y el VEGF-D basal alto.
Las estimaciones de la supervivencia media varían de 10 a 30 años, dependiendo de si se estudian cohortes hospitalarias o poblacionales.
Epidemiología
LAM está casi completamente restringido a las mujeres. Si bien se informa de quistes pulmonares compatibles con LAM en algunos hombres con esclerosis tuberosa, muy pocos de estos hombres desarrollan síntomas. La prevalencia de MELA se estima utilizando datos de registros y grupos de pacientes y se encuentra entre 3,4 y 7,8 / millón de mujeres. El número de casos nuevos cada año se sitúa entre 0,23 y 0,31 / millón de mujeres / año en EE. UU., Reino Unido y Suiza. La variación entre países y entre estados adyacentes en los EE. UU. Sugiere que un número significativo de mujeres con LAM permanece sin diagnosticar o sus síntomas se atribuyen a otras enfermedades. Las mujeres adultas con esclerosis tuberosa tienen más probabilidades de desarrollar LAM que las mujeres sin esclerosis tuberosa. Se han examinado cohortes de pacientes con esclerosis tuberosa para detectar LAM mediante tomografía computarizada. En un estudio retrospectivo de adultos con esclerosis tuberosa, la TC demostró quistes pulmonares en 42% de 95 mujeres y 13% de 91 hombres. En general, los quistes pulmonares eran más grandes y numerosos en mujeres que en hombres. En un estudio retrospectivo adicional de mujeres con CET que se sometieron a una tomografía computarizada para detectar LAM, el 25% de las que tenían 20 años tenían quistes pulmonares, mientras que el 80% de las mujeres de 40 años se vieron afectadas, lo que sugiere que el desarrollo de LAM depende de la edad al menos en LAM relacionado con la esclerosis tuberosa. Aunque la prevalencia de esclerosis tuberosa en 1 de cada 6000 nacimientos es mucho mayor que la de LAM, la mayoría de las clínicas pulmonares ven más casos de LAM esporádica que de esclerosis tuberosa: probablemente debido a una combinación de bajos niveles de detección de LAM en la esclerosis tuberosa y en muchos, la ausencia de síntomas.
El sexo femenino y la esclerosis tuberosa son los únicos factores de riesgo conocidos. Aunque el uso de estrógenos suplementarios no está asociado con el desarrollo de LAM, un estudio sugirió que el uso de píldoras anticonceptivas que contienen estrógenos se asoció con un inicio más temprano.
Ocurre en más del 30% de las mujeres con complejo de esclerosis tuberosa (TSC-LAM), un síndrome hereditario que se asocia con convulsiones , deterioro cognitivo y tumores benignos en múltiples tejidos. La mayoría de los pacientes con LAM que se presentan para evaluación médica tienen la forma esporádica de la enfermedad (S-LAM), sin embargo, que no se asocia con otras manifestaciones del complejo de esclerosis tuberosa.
Se han descrito cambios quísticos leves compatibles con LAM en 10 a 15% de los hombres con CET, pero la LAM sintomática en varones es rara. El MELA esporádico ocurre exclusivamente en mujeres, con una excepción publicada hasta la fecha. Tanto TSC-LAM como S-LAM están asociados con mutaciones en genes de esclerosis tuberosa.
El embarazo
Se ha informado que el embarazo exacerba la LAM en algunos casos. Sin embargo, el riesgo no se ha estudiado rigurosamente. En una encuesta de 318 pacientes que indicaron que habían tenido al menos un embarazo, 163 respondieron a una segunda encuesta centrada en el colapso pulmonar. Un total de 38 pacientes notificaron neumotórax durante el embarazo, lo que coincide con una incidencia de neumotórax durante el embarazo de al menos el 10% (38 de 318). En un tercio de las pacientes, el neumotórax durante el embarazo llevó al diagnóstico de LAM. Los neumotórax fueron casi dos veces más frecuentes en el lado derecho que en el izquierdo, y cuatro mujeres presentaron neumotórax espontáneo bilateral. La mayoría de los neumotórax se produjeron durante el segundo y tercer trimestre. Este estudio y otros sugieren que el embarazo está asociado con complicaciones pleurales en pacientes con LAM. Pocas mujeres con un diagnóstico conocido de LAM eligen quedar embarazadas y las pacientes a las que se les diagnostica LAM durante el embarazo rara vez tienen pruebas de función pulmonar iniciales disponibles, lo que complica la resolución de esta cuestión.
Sociedad
La Fundación LAM se fundó en 1995 como una organización de base para brindar apoyo a los pacientes y financiamiento para la investigación. Hoy, la Fundación LAM brinda apoyo y educación a mujeres con LAM y sus familias, involucra a médicos y científicos para que continúen aprendiendo más sobre la enfermedad y recauda fondos para el estudio continuo de LAM. Busca tratamientos seguros y eficaces y, en última instancia, una cura para la linfangioleiomiomatosis. Tiene su sede en Cincinnati, Ohio.
En la cultura popular
En " Lucky Thirteen ", el quinto episodio de la quinta temporada de House , Spencer (Angela Gots) fue diagnosticada con LAM, aunque más tarde se descubrió que era un caso del síndrome de Sjögren .
Ver también
Referencias
enlaces externos
- American Thoracic Society (EE. UU.): Serie de información para el paciente - Linfangioleiomiomatosis
| Clasificación | |
|---|---|
| Recursos externos |