Yodo-131 - Iodine-131
| General | |
|---|---|
| Símbolo | 131 Yo |
| Nombres | yodo-131, I-131, yodo radiactivo |
| Protones | 53 |
| Neutrones | 78 |
| Datos de nucleidos | |
| Media vida | 8.0197 días |
| Masa de isótopos | 130.9061246 (12) u |
| Exceso de energia | 971 keV |
|
Isótopos de yodo Tabla completa de nucleidos | |
El yodo-131 ( 131 I , I-131 ) es un importante radioisótopo de yodo descubierto por Glenn Seaborg y John Livingood en 1938 en la Universidad de California, Berkeley. Tiene una vida media de desintegración radiactiva de unos ocho días. Está asociado con la energía nuclear, los procedimientos de diagnóstico y tratamiento médicos y la producción de gas natural. También juega un papel importante como isótopo radiactivo presente en los productos de fisión nuclear , y fue un contribuyente significativo a los peligros para la salud de las pruebas de bombas atómicas al aire libre en la década de 1950 y del desastre de Chernobyl , además de ser una gran fracción de el peligro de contaminación en las primeras semanas de la crisis nuclear de Fukushima . Esto se debe a que el 131 I es un producto de fisión importante del uranio y el plutonio , que comprende casi el 3% del total de productos de fisión (en peso). Consulte el rendimiento del producto de fisión para una comparación con otros productos de fisión radiactivos. El 131 I es también un importante producto de fisión del uranio-233, producido a partir del torio .
Debido a su modo de desintegración beta , el yodo-131 causa mutación y muerte en las células que penetra y en otras células hasta varios milímetros de distancia. Por esta razón, las dosis altas del isótopo a veces son menos peligrosas que las dosis bajas, ya que tienden a matar los tejidos tiroideos que de otro modo se volverían cancerosos como resultado de la radiación. Por ejemplo, los niños tratados con una dosis moderada de 131 I para los adenomas de tiroides tuvieron un aumento detectable de cáncer de tiroides, pero los niños tratados con una dosis mucho más alta no lo hicieron. Del mismo modo, la mayoría de los estudios de 131 I en dosis muy altas para el tratamiento de la enfermedad de Graves no han logrado encontrar ningún aumento en el cáncer de tiroides, a pesar de que existe un aumento lineal en el riesgo de cáncer de tiroides con la absorción de 131 I en dosis moderadas. Por lo tanto, el yodo-131 se emplea cada vez menos en pequeñas dosis en uso médico (especialmente en niños), pero cada vez más se usa solo en dosis de tratamiento grandes y máximas, como una forma de matar los tejidos diana. Esto se conoce como "uso terapéutico".
El yodo-131 se puede "ver" mediante técnicas de formación de imágenes de medicina nuclear (es decir, cámaras gamma ) siempre que se administre para uso terapéutico, ya que aproximadamente el 10% de su dosis de energía y radiación es a través de la radiación gamma. Sin embargo, dado que el otro 90% de la radiación (radiación beta) causa daño tisular sin contribuir a la capacidad de ver o "crear imágenes" del isótopo, se prefieren otros radioisótopos de yodo menos dañinos, como el yodo-123 (ver isótopos de yodo ). en situaciones en las que solo se requieren imágenes nucleares. El isótopo 131 I todavía se usa ocasionalmente para trabajos puramente de diagnóstico (es decir, formación de imágenes), debido a su bajo costo en comparación con otros radioisótopos de yodo. Las dosis muy pequeñas de imágenes médicas de 131 I no han mostrado ningún aumento en el cáncer de tiroides. La disponibilidad de bajo costo de 131 I, a su vez, se debe a la relativa facilidad de crear 131 I mediante el bombardeo de neutrones de telurio natural en un reactor nuclear, y luego separar el 131 I por varios métodos simples (es decir, calentar para expulsar el yodo volátil). Por el contrario, otros radioisótopos de yodo generalmente se crean mediante técnicas mucho más caras, comenzando con la radiación ciclotrónica de cápsulas de gas xenón presurizado .
El yodo-131 es también uno de los trazadores industriales radiactivos emisores de rayos gamma más utilizados . Los isótopos trazadores radiactivos se inyectan con fluido de fracturación hidráulica para determinar el perfil de inyección y la ubicación de las fracturas creadas por la fracturación hidráulica.
Algunos estudios suponen que dosis incidentales de yodo-131 mucho más pequeñas que las que se utilizan en procedimientos médicos terapéuticos son la principal causa del aumento de los cánceres de tiroides después de la contaminación nuclear accidental. Estos estudios suponen que los cánceres ocurren por el daño residual de la radiación en los tejidos causado por el 131 I, y deberían aparecer principalmente años después de la exposición, mucho después de que el 131 I haya decaído. Otros estudios no encontraron correlación.
Producción
La mayor parte de la producción de 131 I proviene de la irradiación de neutrones de un objetivo de telurio natural en un reactor nuclear. La irradiación del telurio natural produce casi en su totalidad 131 I como único radionúclido con una vida media superior a horas, ya que la mayoría de los isótopos más ligeros del telurio se convierten en isótopos estables más pesados, o bien en yodo o xenón estables. Sin embargo, el núclido de telurio natural más pesado, 130 Te (34% del telurio natural) absorbe un neutrón para convertirse en telurio-131, cuya beta se desintegra con una vida media de 25 minutos a 131 I.
Se puede irradiar un compuesto de telurio mientras está unido como un óxido a una columna de intercambio iónico, con el 131 I desprendido luego eluido en una solución alcalina. Más comúnmente, el telurio elemental en polvo se irradia y luego se separa el 131 I por destilación seca del yodo, que tiene una presión de vapor mucho más alta . A continuación, el elemento se disuelve en una solución ligeramente alcalina de la manera estándar, para producir 131 I como yoduro e hipoyodato (que pronto se reduce a yoduro).
El 131 I es un producto de fisión con un rendimiento del 2,878% a partir del uranio 235 y puede liberarse en ensayos de armas nucleares y accidentes nucleares . Sin embargo, la vida media corta significa que no está presente en cantidades significativas en el combustible nuclear gastado enfriado , a diferencia del yodo-129, cuya vida media es casi mil millones de veces mayor que la del 131 I.
Es descargado a la atmósfera en pequeñas cantidades por algunas centrales nucleares.
Desintegración radioactiva
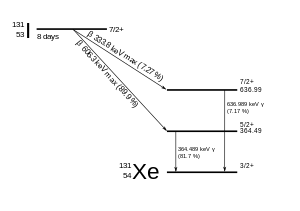
El 131 I se desintegra con una vida media de 8.02 días con emisiones beta menos y gamma . Este isótopo de yodo tiene 78 neutrones en su núcleo, mientras que el único nucleido estable, 127 I, tiene 74. Al descomponerse, el 131 I con mayor frecuencia (89% del tiempo) gasta sus 971 keV de energía de descomposición transformándose en xenón estable. 131 en dos pasos, con la desintegración gamma seguida rápidamente después de la desintegración beta:
Las emisiones primarias de la desintegración de 131 I son, por tanto, electrones con una energía máxima de 606 keV (89% de abundancia, otros 248–807 keV) y rayos gamma de 364 keV (81% de abundancia, otros 723 keV). La desintegración beta también produce un antineutrino , que se lleva cantidades variables de energía de desintegración beta. Los electrones, debido a su alta energía media (190 keV, con los típicos espectros de desintegración beta presentes) tienen una penetración tisular de 0,6 a 2 mm .
Efectos de la exposición
El cuerpo absorbe el yodo de los alimentos y se concentra preferentemente en la tiroides, donde es necesario para el funcionamiento de esa glándula. Cuando el 131 I está presente en niveles altos en el medio ambiente debido a la lluvia radiactiva , puede absorberse a través de alimentos contaminados y también se acumulará en la tiroides. A medida que se descompone, puede dañar la tiroides. El riesgo principal de la exposición al 131 I es un mayor riesgo de cáncer inducido por radiación en la edad adulta. Otros riesgos incluyen la posibilidad de crecimientos no cancerosos y tiroiditis .
El riesgo de cáncer de tiroides en la vejez parece disminuir con la edad en el momento de la exposición. La mayoría de las estimaciones de riesgo se basan en estudios en los que se produjeron exposiciones a la radiación en niños o adolescentes. Cuando los adultos están expuestos, ha sido difícil para los epidemiólogos detectar una diferencia estadísticamente significativa en las tasas de enfermedad de la tiroides por encima de la de un grupo similar pero no expuesto.
El riesgo se puede mitigar tomando suplementos de yodo, aumentando la cantidad total de yodo en el cuerpo y, por lo tanto, reduciendo la captación y retención en la cara y el pecho y disminuyendo la proporción relativa de yodo radiactivo. Sin embargo, esos suplementos no se distribuyeron sistemáticamente a la población que vivía más cerca de la central nuclear de Chernobyl después del desastre, aunque se distribuyeron ampliamente entre los niños de Polonia.
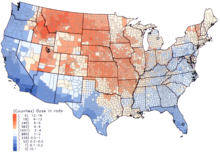
En los EE. UU., Las dosis más altas de lluvia radiactiva de 131 I se produjeron durante la década de 1950 y principios de la de 1960 en niños que habían consumido leche fresca de fuentes contaminadas como resultado de pruebas de armas nucleares en la superficie. El Instituto Nacional del Cáncer proporciona información adicional sobre los efectos en la salud de la exposición al 131 I en la lluvia radiactiva, así como estimaciones individualizadas, para los nacidos antes de 1971, para cada uno de los 3070 condados de EE. UU. Los cálculos se toman de los datos recopilados con respecto a las consecuencias de las pruebas de armas nucleares realizadas en el sitio de pruebas de Nevada .
El 27 de marzo de 2011, el Departamento de Salud Pública de Massachusetts informó que se detectó 131 I en concentraciones muy bajas en el agua de lluvia de muestras recolectadas en Massachusetts, EE. UU., Y que probablemente se originó en la planta de energía de Fukushima. Los agricultores cerca de la planta de leche cruda objeto de dumping, mientras que las pruebas en los Estados Unidos encontró 0,8 pico- curios por litro de yodo-131 en una muestra de leche, pero los niveles de radiación eran 5.000 veces más bajo que el "nivel de intervención definida" de la FDA. Se esperaba que los niveles cayeran relativamente rápido
Tratamiento y prevención
Un método de tratamiento común para la prevención de la exposición de yodo-131 es por saturación de la tiroides con, estable regular de yodo-127 , como un yoduro o yodato de sal. El yodo elemental libre no debe usarse para saturar la tiroides porque es un oxidante corrosivo y, por lo tanto, es tóxico para ingerirlo en las cantidades necesarias. La tiroides absorberá muy poco del yodo-131 radiactivo después de que se sature con yoduro no radiactivo, evitando así el daño causado por la radiación del yodo radiactivo .
Método de tratamiento común
El método de tratamiento más común es administrar yoduro de potasio a las personas en riesgo. La dosis para adultos es de 130 mg de yoduro de potasio por día, administrada en una sola dosis o dividida en porciones de 65 mg dos veces al día. Esto equivale a 100 mg de yodo y es aproximadamente 700 veces mayor que la dosis nutricional de yodo, que es de 0,150 mg por día (150 microgramos por día). Consulte yoduro de potasio para obtener más información sobre la prevención de la absorción de yodo radiactivo por la tiroides durante un accidente nuclear o por razones médicas nucleares . Las dosis de yoduro de potasio aprobadas por la FDA para este propósito son las siguientes: bebés menores de 1 mes, 16 mg; niños de 1 mes a 3 años, 32 mg; niños de 3 a 18 años, 65 mg; adultos 130 mg. Sin embargo, algunas fuentes recomiendan regímenes de dosificación alternativos.
| Edad | KI en mg | KIO 3 en mg |
|---|---|---|
| Mayores de 12 años | 130 | 170 |
| 3 a 12 años | sesenta y cinco | 85 |
| 1-36 meses de edad | 32 | 42 |
| <1 mes de edad | dieciséis | 21 |
La ingestión de yoduro y yodato de profilaxis no está exenta de peligros. Hay motivos de precaución sobre la ingesta de yoduro de potasio o suplementos de yodo, ya que su uso innecesario puede provocar afecciones como el fenómeno Jod-Basedow y el efecto Wolff-Chaikoff , desencadenante y / o empeoran el hipertiroidismo y el hipotiroidismo , respectivamente, y finalmente causan afecciones de la tiroides temporales o incluso permanentes. También puede causar sialoadenitis (una inflamación de la glándula salival), alteraciones gastrointestinales, reacciones alérgicas y erupciones cutáneas.
Tableta de yodo
También se ha determinado que el uso de una "tableta de yodo" particular utilizada en la purificación de agua portátil es algo eficaz para reducir la absorción de yodo radiactivo. En un pequeño estudio en sujetos humanos que, para cada uno de sus 90 días de prueba, ingirieron cuatro tabletas de agua de 20 miligramos de hidroperioduro de tetraglicina (TGHP), con cada tableta liberando 8 miligramos (ppm) de yodo titulable libre; se encontró que la captación biológica de yodo radiactivo en estos sujetos humanos descendió y permaneció en un valor de menos del 2% de la tasa de captación de yodo radiactivo de la observada en los sujetos de control que estaban completamente expuestos al yodo radiactivo sin tratamiento.
Goitrogen
La administración de sustancias conocidas de bocio también se puede utilizar como profilaxis para reducir la absorción biológica de yodo (ya sea yodo-127 no radiactivo nutricional o yodo radiactivo, yodo radiactivo, más comúnmente yodo-131, ya que el cuerpo no puede discernir entre diferentes isótopos de yodo ). Se ha demostrado que los iones de perclorato , un contaminante del agua común en los EE. UU. Debido a la industria aeroespacial , reducen la absorción de yodo y, por lo tanto, se clasifican como un bocio . Los iones de perclorato son un inhibidor competitivo del proceso por el cual el yoduro se deposita activamente en las células foliculares tiroideas. Los estudios en los que participaron voluntarios adultos sanos determinaron que a niveles superiores a 0,007 miligramos por kilogramo por día (mg / (kg · d)), el perclorato comienza a inhibir temporalmente la capacidad de la glándula tiroides para absorber yodo del torrente sanguíneo ("inhibición de la captación de yoduro", es decir, perclorato es un bocio conocido). La reducción de la reserva de yoduro por el perclorato tiene efectos duales: reducción del exceso de síntesis de hormonas e hipertiroidismo, por un lado, y reducción de la síntesis de inhibidores de la tiroides e hipotiroidismo, por el otro. El perclorato sigue siendo muy útil como aplicación de dosis única en las pruebas que miden la descarga de yoduro radiactivo acumulado en la tiroides como resultado de muchas alteraciones diferentes en el metabolismo ulterior del yoduro en la glándula tiroides.
Tirotoxicosis
El tratamiento de la tirotoxicosis (incluida la enfermedad de Graves) con 600 a 2000 mg de perclorato de potasio (430 a 1400 mg de perclorato) al día durante períodos de varios meses o más fue una práctica común, particularmente en Europa, y el uso de perclorato en dosis más bajas para tratar los problemas de tiroides continúa hasta el día de hoy. Aunque inicialmente se usaron 400 mg de perclorato de potasio divididos en cuatro o cinco dosis diarias y se encontró que eran efectivos, se introdujeron dosis más altas cuando se descubrió que 400 mg / día no controlaban la tirotoxicosis en todos los sujetos.
Los regímenes actuales para el tratamiento de la tirotoxicosis (incluida la enfermedad de Graves), cuando un paciente está expuesto a fuentes adicionales de yodo, por lo general incluyen 500 mg de perclorato de potasio dos veces al día durante 18 a 40 días.
Se encontró que la profilaxis con agua que contiene perclorato a concentraciones de 17 ppm , que corresponde a una ingesta personal de 0.5 mg / kg por día, si uno pesa 70 kg y consume dos litros de agua por día, reduce la absorción basal de yodo radiactivo en un 67%. equivalente a ingerir un total de solo 35 mg de iones de perclorato por día. En otro estudio relacionado en el que los sujetos bebieron solo 1 litro de agua que contenía perclorato por día a una concentración de 10 ppm, es decir, se ingirieron 10 mg diarios de iones de perclorato, se observó una reducción promedio del 38% en la absorción de yodo.
Sin embargo, cuando la absorción promedio de perclorato en los trabajadores de la planta de perclorato sometidos a la exposición más alta se ha estimado en aproximadamente 0,5 mg / kg-día, como en el párrafo anterior, se esperaría una reducción del 67% en la absorción de yodo. Los estudios de trabajadores expuestos crónicamente, sin embargo, hasta ahora no han logrado detectar anomalías de la función tiroidea, incluida la absorción de yodo. Esto bien puede ser atribuible a una exposición o ingesta diaria suficiente de yodo-127 saludable entre los trabajadores y a la corta vida media biológica de 8 horas del perclorato en el cuerpo.
Captación de yodo-131
Por lo tanto, bloquear completamente la absorción de yodo-131 mediante la adición intencional de iones de perclorato al suministro de agua de una población, con el objetivo de dosis de 0.5 mg / kg-día, o una concentración de agua de 17 ppm, sería extremadamente inadecuado para reducir realmente el yodo radiactivo. consumo. Por lo tanto, las concentraciones de iones perclorato en el suministro de agua de una región tendrían que ser mucho más altas, con al menos una dosis total de 7,15 mg / kg de peso corporal por día que se debe alcanzar, y esto se puede lograr para la mayoría de los adultos al consumir 2 litros de agua por día con una concentración de agua de 250 mg / kg de agua, o 250 ppm de iones perclorato por litro; sólo a este nivel el consumo de perclorato ofrecería una protección adecuada y sería realmente beneficioso para la población al prevenir la bioacumulación cuando se expone a un ambiente de yodo radiactivo. Esto es completamente independiente de la disponibilidad de yodatos o fármacos con yoduro .
La adición continua de perclorato al suministro de agua debería continuar durante no menos de 80 a 90 días, comenzando inmediatamente después de que se detecte la liberación inicial de yodo radiactivo; después de que hayan pasado 80-90 días, el yodo-131 radiactivo liberado se habrá desintegrado a menos del 0,1% de su cantidad inicial y, por lo tanto, el peligro de la absorción biológica de yodo-131 ha terminado esencialmente.
Liberación de yodo radiactivo
En el caso de una liberación de yodo radiactivo, la ingestión de yoduro o yodato de potasio para profilaxis, si estuviera disponible, tendría preferencia sobre la administración de perclorato y sería la primera línea de defensa para proteger a la población de una liberación de yodo radiactivo. Sin embargo, en el caso de una liberación de yodo radiactivo demasiado masiva y generalizada para ser controlada por las existencias limitadas de fármacos profilácticos de yodo y yodato, la adición de iones de perclorato al suministro de agua o la distribución de tabletas de perclorato serviría como un método barato y económico. Segunda línea de defensa eficaz contra la bioacumulación cancerígena de yodo radiactivo.
Al igual que el yoduro de potasio , la ingestión de medicamentos con bocio no está exenta de peligros, como el hipotiroidismo . Sin embargo, en todos estos casos, a pesar de los riesgos, los beneficios profilácticos de la intervención con yoduro, yodato o perclorato superan el riesgo grave de cáncer por bioacumulación de yodo radiactivo en regiones donde el yodo radiactivo ha contaminado suficientemente el medio ambiente.
Uso medico

El yodo-131 se usa para la radioterapia de fuente no sellada en medicina nuclear para tratar varias afecciones. También puede ser detectado por cámaras gamma para diagnóstico por imagen , sin embargo, rara vez se administra solo con fines de diagnóstico, el diagnóstico por imágenes se realizará normalmente después de una dosis terapéutica. El uso del 131 I como sal de yoduro aprovecha el mecanismo de absorción del yodo por las células normales de la glándula tiroides .
El tratamiento de la tirotoxicosis.
Los usos principales de 131 I incluyen el tratamiento de la tirotoxicosis (hipertiroidismo) debido a la enfermedad de Graves y, a veces, nódulos tiroideos hiperactivos (tejido tiroideo anormalmente activo que no es maligno). El uso terapéutico del yodo radiactivo para tratar el hipertiroidismo de la enfermedad de Graves fue informado por primera vez por Saul Hertz en 1941. La dosis generalmente se administra por vía oral (ya sea en forma de líquido o cápsula), en un entorno ambulatorio , y por lo general es de 400 a 600 megabecquerels (MBq ). El yodo radiactivo (yodo-131) solo puede empeorar potencialmente la tirotoxicosis en los primeros días después del tratamiento. Un efecto secundario del tratamiento es un período inicial de unos pocos días de aumento de los síntomas de hipertiroidismo. Esto ocurre porque cuando el yodo radiactivo destruye las células tiroideas, estas pueden liberar hormona tiroidea al torrente sanguíneo. Por esta razón, a veces los pacientes reciben un tratamiento previo con medicamentos tirostáticos como el metimazol y / o reciben un tratamiento sintomático como el propranolol. El tratamiento con yodo radiactivo está contraindicado en la lactancia y el embarazo.
Tratamiento del cáncer de tiroides
El yodo-131, en dosis más altas que para la tirotoxicosis, se usa para la ablación del tejido tiroideo remanente después de una tiroidectomía completa para tratar el cáncer de tiroides .
Administración de I-131 para ablación
Las dosis terapéuticas típicas de I-131 están entre 2220-7400 megabecquerels (MBq). Debido a esta alta radiactividad y debido a que la exposición del tejido del estómago a la radiación beta sería alta cerca de una cápsula no disuelta, algunas veces se administra I-131 a pacientes humanos en una pequeña cantidad de líquido. La administración de esta forma líquida suele ser mediante una pajita que se utiliza para aspirar lenta y cuidadosamente el líquido de un recipiente protegido. Para la administración a animales (por ejemplo, gatos con hipertiroidismo), por razones prácticas, el isótopo debe administrarse mediante inyección. Las guías europeas recomiendan la administración de una cápsula, debido a "la mayor facilidad para el paciente y la superior protección radiológica para los cuidadores".
Aislamiento postratamiento
Las dosis de ablación se administran habitualmente de forma hospitalaria , y las Normas Básicas Internacionales de Seguridad del OIEA recomiendan que los pacientes no sean dados de alta hasta que la actividad descienda por debajo de 1100 MBq. El consejo de la CIPR establece que los "consoladores y cuidadores" de los pacientes sometidos a terapia con radionúclidos deben ser tratados como miembros del público con fines de restricción de dosis y cualquier restricción sobre el paciente debe diseñarse sobre la base de este principio.
A las pacientes que reciben tratamiento con yodo radiactivo I-131 se les puede advertir que no tengan relaciones sexuales durante un mes (o menos, dependiendo de la dosis administrada), ya las mujeres se les puede decir que no se embarazen durante los seis meses posteriores. "Esto se debe a que existe un riesgo teórico para un feto en desarrollo, aunque la cantidad de radiactividad retenida puede ser pequeña y no hay pruebas médicas de un riesgo real del tratamiento con yodo radiactivo. Esta precaución eliminaría esencialmente la exposición fetal directa a la radiactividad y reducir la posibilidad de concepción con espermatozoides que, en teoría, podrían haber sido dañados por la exposición al yodo radiactivo ". Estas pautas varían de un hospital a otro y dependerán de la legislación y las pautas nacionales, así como de la dosis de radiación administrada. Algunos también aconsejan no abrazar ni abrazar a los niños cuando la radiación aún es alta, y se puede recomendar una distancia de uno o dos metros con los demás.
El I-131 se eliminará del cuerpo durante las próximas semanas después de su administración. La mayor parte del I-131 se eliminará del cuerpo humano en 3-5 días, por descomposición natural y por excreción en el sudor y la orina. Se seguirán liberando cantidades más pequeñas durante las próximas semanas, a medida que el cuerpo procese las hormonas tiroideas creadas con el I-131. Por este motivo, se aconseja limpiar periódicamente los inodoros, lavabos, sábanas y ropa utilizada por la persona que recibió el tratamiento. También se puede recomendar a los pacientes que usen pantuflas o calcetines en todo momento y que eviten el contacto cercano prolongado con otras personas. Esto minimiza la exposición accidental de los miembros de la familia, especialmente los niños. Se puede recomendar el uso de un descontaminante especialmente elaborado para la eliminación de yodo radiactivo. No se recomienda el uso de soluciones de blanqueador de cloro o limpiadores que contengan blanqueador de cloro para la limpieza, ya que se puede liberar gas de yodo elemental radiactivo. El I-131 en el aire puede causar un mayor riesgo de exposición de segunda mano, esparciendo la contaminación sobre un área amplia. Se aconseja al paciente que, si es posible, permanezca en una habitación con un baño conectado para limitar la exposición involuntaria de los miembros de la familia.
Muchos aeropuertos cuentan ahora con detectores de radiación para detectar el contrabando de materiales radiactivos. Se debe advertir a los pacientes que si viajan en avión, pueden activar detectores de radiación en los aeropuertos hasta 95 días después de su tratamiento con 131 I.
Otros usos terapéuticos
El isótopo 131 I también se usa como marcador radiactivo para ciertos radiofármacos que pueden usarse para terapia, por ejemplo, 131 I- metayodobencilguanidina ( 131 I-MIBG) para la formación de imágenes y el tratamiento de feocromocitoma y neuroblastoma . En todos estos usos terapéuticos, el 131 I destruye el tejido mediante radiación beta de corto alcance . Aproximadamente el 90% de su daño por radiación en los tejidos es a través de la radiación beta, y el resto ocurre a través de su radiación gamma (a una distancia mayor del radioisótopo). Se puede ver en las exploraciones de diagnóstico después de su uso como terapia, porque el 131 I también es un emisor de rayos gamma.
Usos diagnósticos
Debido a la carcinogenicidad de su radiación beta en la tiroides en pequeñas dosis, el I-131 rara vez se usa principalmente o únicamente para el diagnóstico (aunque en el pasado esto era más común debido a la relativa facilidad de producción y bajo costo de este isótopo). En su lugar, el yodo radiactivo 123, que emite más puramente gamma, se utiliza en las pruebas de diagnóstico ( escáner de medicina nuclear de la tiroides). El yodo-125 de vida media más larga también se usa ocasionalmente cuando se necesita un yodo radiactivo de vida media más larga para el diagnóstico, y en el tratamiento de braquiterapia (isótopo confinado en pequeñas cápsulas metálicas similares a semillas), donde la radiación gamma de baja energía sin una beta hace que el yodo-125 sea útil. Los otros radioisótopos de yodo nunca se utilizan en braquiterapia.
Se ha culpado al uso de 131 I como isótopo médico por el rechazo de un envío rutinario de biosólidos para cruzar la frontera entre Canadá y Estados Unidos. Dicho material puede ingresar a las alcantarillas directamente desde las instalaciones médicas, o al ser excretado por los pacientes después de un tratamiento.
Usos de trazadores radiactivos industriales
Utilizado por primera vez en 1951 para localizar fugas en un sistema de suministro de agua potable de Munich , Alemania, el yodo-131 se convirtió en uno de los trazadores radiactivos industriales emisores de rayos gamma más utilizados , con aplicaciones en hidrología isotópica y detección de fugas.
Desde finales de la década de 1940, la industria petrolera ha utilizado trazadores radiactivos. Etiquetado en la superficie, el agua luego se rastrea en el fondo del pozo, utilizando el detector gamma apropiado, para determinar los flujos y detectar fugas subterráneas. El I-131 ha sido el isótopo de marcado más utilizado en una solución acuosa de yoduro de sodio . Se utiliza para caracterizar el fluido de fracturación hidráulica para ayudar a determinar el perfil de inyección y la ubicación de las fracturas creadas por la fracturación hidráulica .
Ver también
Referencias
enlaces externos
- "Ficha informativa ANL" (PDF) . Archivado desde el original (PDF) el 14 de junio de 2003.
- RadiologyInfo - El recurso de información radiológica para pacientes: Terapia con yodo radiactivo (I −131)
- Estudios de caso en medicina ambiental: exposición a la radiación del yodo 131
- Sensibilidad de los detectores de radiación personales de seguridad nacional a los radionúclidos médicos e implicaciones para el asesoramiento de pacientes de medicina nuclear
- Banco de datos de sustancias peligrosas del NLM: yodo, radiactivo