Nefropatía diabética - Diabetic nephropathy
| Nefropatía diabética | |
|---|---|
| Otros nombres | Enfermedad renal diabética |
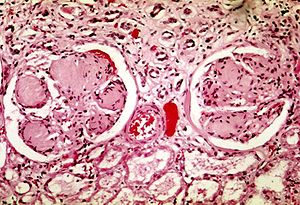 | |
| Dos glomérulos en la nefropatía diabética: las áreas acelulares de color púrpura claro dentro de los mechones capilares son los depósitos destructivos de la matriz mesangial. | |
| Especialidad |
Nefrología , endocrinología |
| Síntomas | Albuminuria , edema periférico , hipertensión arterial, cansancio |
| Factores de riesgo | Presión arterial alta, tabaquismo , glucosa en sangre inestable |
| Método de diagnóstico | Niveles anormales de albúmina urinaria. |
| Prevención | Dejar de fumar |
| Tratamiento | Inhibidores de la ECA |
La nefropatía diabética , también conocida como enfermedad renal diabética , es la pérdida crónica de la función renal que ocurre en personas con diabetes mellitus . La nefropatía diabética es una de las principales causas de enfermedad renal crónica (ERC) y enfermedad renal en etapa terminal (ESRD) a nivel mundial. La pérdida de proteínas en la orina debido al daño de los glomérulos puede volverse masiva y causar una albúmina sérica baja con la consiguiente hinchazón corporal generalizada (edema) y resultar en el síndrome nefrótico . Asimismo, la tasa de filtración glomerular estimada (eGFR) puede descender progresivamente de un valor normal de más de 90 ml / min / 1,73 m 2 a menos de 15, momento en el que se dice que el paciente tiene una enfermedad renal en etapa terminal . Por lo general, progresa lentamente a lo largo de los años.
Las anomalías fisiopatológicas en la nefropatía diabética comienzan con niveles de glucosa en sangre mal controlados durante mucho tiempo. A esto le siguen múltiples cambios en las unidades de filtración de los riñones, las nefronas . (Normalmente hay alrededor de 750 000 a 1,5 millones de nefronas en cada riñón adulto). Inicialmente, hay constricción de las arteriolas eferentes y dilatación de las arteriolas aferentes , con la consiguiente hipertensión e hiperfiltración de los capilares glomerulares; esto cambia gradualmente a hipofiltración con el tiempo. Al mismo tiempo, hay cambios dentro del propio glomérulo: estos incluyen un engrosamiento de la membrana basal , un ensanchamiento de las membranas de hendidura de los podocitos , un aumento en el número de células mesangiales y un aumento en la matriz mesangial. Esta matriz invade los capilares glomerulares y produce depósitos denominados nódulos de Kimmelstiel-Wilson. Las células mesangiales y la matriz pueden expandirse progresivamente y consumir todo el glomérulo, interrumpiendo la filtración.
El estado de la nefropatía diabética se puede controlar midiendo dos valores: la cantidad de proteína en la orina - proteinuria ; y un análisis de sangre llamado creatinina sérica . La cantidad de proteinuria refleja el grado de daño de los glomérulos aún en funcionamiento. El valor de la creatinina sérica se puede utilizar para calcular la tasa de filtración glomerular estimada (eGFR), que refleja el porcentaje de glomérulos que ya no filtran la sangre. Tratamiento con un inhibidor de la enzima convertidora de angiotensina o un bloqueador del receptor de angiotensina , que dilata la arteriola que sale del glomérulo, reduciendo así la presión arterial dentro de los capilares glomerulares, lo que puede ralentizar (pero no detener) la progresión de la enfermedad. También se cree que tres clases de medicamentos para la diabetes ( agonistas de GLP-1 , inhibidores de DPP-4 e inhibidores de SGLT2 ) retrasan la progresión de la nefropatía diabética.
La nefropatía diabética es la causa más común de enfermedad renal en etapa terminal y es una complicación grave que afecta aproximadamente a una cuarta parte de los adultos con diabetes en los Estados Unidos. Las personas afectadas con enfermedad renal en etapa terminal a menudo requieren hemodiálisis y, finalmente, un trasplante de riñón para reemplazar la función renal defectuosa. La nefropatía diabética se asocia con un mayor riesgo de muerte en general, particularmente por enfermedad cardiovascular .
Signos y síntomas
El inicio de los síntomas es de 5 a 10 años después del comienzo de la enfermedad. Un primer síntoma habitual es la micción frecuente por la noche: nicturia . Otros síntomas incluyen cansancio , dolores de cabeza , sensación general de enfermedad , náuseas , vómitos , micción frecuente durante el día, falta de apetito , picazón en la piel e hinchazón de las piernas . La presentación clínica de la nefropatía diabética (ND) se caracteriza por proteinuria (proteína en la orina), hipertensión y pérdida progresiva de la función renal. El proceso puede ser inicialmente indolente, lo que hace que el cribado regular de la nefropatía diabética en pacientes con diabetes mellitus sea de gran importancia.
Factores de riesgo
No todos los pacientes con diabetes desarrollan nefropatía diabética. Los principales factores de riesgo que aumentan la probabilidad de desarrollar nefropatía diabética son:
- Control deficiente de la glucosa en sangre.
- Presión arterial alta incontrolada
- Diabetes mellitus tipo 1 , que comienza antes de los 20 años
- Uso pasado o actual de cigarrillos
- Antecedentes familiares de nefropatía diabética: se han identificado ciertos genes asociados con la ND. (Sin embargo, todavía no se ha establecido una correlación directa. Uno de estos genes es APOL1, que se ha encontrado asociado con nefropatía en individuos afroamericanos).
- Ciertos grupos raciales (afroamericanos, mexicoamericanos e indios pima tienen mayor riesgo).
Fisiopatología

La progresión de la enfermedad de la nefropatía diabética implica varias etapas clínicas: hiperfiltración, microalbuminuria, macroalbuminuria, proteinuria nefrótica a enfermedad renal crónica progresiva que conduce a enfermedad renal en etapa terminal (ESRD). El daño se ejerce en todos los compartimentos del riñón: el glomérulo, los túbulos renales, la vasculatura (arteriolas renales aferentes y eferentes) y el intersticio. La fibrosis renal es la vía final común de la ND. Esta fibrosis es producto de múltiples mecanismos que incluyen cambios hemodinámicos renales, anomalías del metabolismo de la glucosa asociadas con el estrés oxidativo, así como procesos inflamatorios y un sistema renina-angiotensina-aldosterona hiperactivo (RAAS).
Se cree que la fisiopatología de la nefropatía diabética implica una interacción entre factores hemodinámicos y metabólicos.
Los factores hemodinámicos incluyen un aumento de la presión sistémica e intraglomerular, así como la sobreactivación del RAAS. Los estudios han demostrado que en el contexto de la diabetes, varios factores estimulan el RAAS, que es una de las vías más importantes en la fisiopatología de la nefropatía diabética. Debido a la mayor carga de glucosa filtrada, hay una regulación positiva en el cotransportador de sodio-glucosa 2 (SGLT2) en los túbulos proximales, que cotransporta el sodio y la glucosa de regreso a la circulación. Esto conduce a una disminución en el suministro de cloruro de sodio a la mácula densa en los túbulos distales, lo que promueve la liberación de renina y sobreactiva el RAAS. La hiperfiltración es una de las primeras características de DN. Se han propuesto varios mecanismos para causar hiperfiltración. Uno de estos mecanismos es que a medida que los glomérulos se hipertrofian, la superficie de filtración aumenta inicialmente. Otro posible mecanismo es que el control vascular anormal en la nefropatía diabética conduce a una reducción de la resistencia arteriolar glomerular aferente y un aumento de la resistencia arteriolar glomerular eferente, lo que lleva a un aumento neto del flujo sanguíneo renal (RBF) y la tasa de filtración glomerular (TFG). La hiperfiltración glomerular y una regulación aberrante de RAAS conducen a un aumento de la presión intraglomerular, provocando estrés en las células endoteliales, las células mesangiales y los podocitos. Esto agrava la disfunción causada por los efectos metabólicos de la hiperglucemia.
Los factores metabólicos incluyen la formación de productos finales de glicación avanzada (AGE), que tienen un papel central en la fisiopatología de muchas de las complicaciones de la diabetes mellitus, incluidas las complicaciones cardiovasculares. Los AGE son grupos químicos que se forman cuando un azúcar reductor (glucosa en este caso) reacciona de forma no enzimática con un grupo amina, predominantemente lisina y arginina, que están unidos a proteínas, lípidos y ácidos nucleicos. Estos productos de glicación se acumulan en las proteínas del colágeno de la pared de los vasos, formando un complejo irreversible de AGE reticulados. Una forma importante en la que los AGE ejercen su efecto es a través de un mecanismo mediado por receptores, sobre todo por el receptor de productos finales de glicación avanzada (RAGE). RAGE es un receptor de transducción de señales que se encuentra en varios tipos de células, incluidos macrófagos, células endoteliales, células mesangiales renales y podocitos en el glomérulo. La unión de los AGE a los receptores RAGE mejora la producción de especies reactivas de oxígeno (ROS) citosólicas y estimula moléculas intracelulares como la proteína quinasa C (PKC), NF-kB y la activación de los factores de crecimiento TGF-B y el factor de crecimiento endotelial vascular (VEGF). ). Estos factores, junto con los cambios hemodinámicos que ocurren, conducen a lesión de podocitos, estrés oxidativo, inflamación y fibrosis. A medida que la lesión empeora, la función renal disminuye y la membrana basal glomerular (MBG) se vuelve más permeable y menos eficiente en la filtración. Esto se acompaña de una disminución constante de la función renal.
Diagnóstico
El diagnóstico se basa en la medición de niveles anormales de albúmina urinaria en un diabético junto con la exclusión de otras causas de albuminuria. Las mediciones de albúmina se definen de la siguiente manera:
- Albuminuria normal : excreción urinaria de albúmina <30 mg / 24 h;
- Microalbuminuria : excreción urinaria de albúmina en el rango de 30-299 mg / 24 h;
- Macroalbuminuria : excreción urinaria de albúmina ≥ 300 mg / 24 h
- La excreción urinaria de albúmina también se puede medir mediante la relación albúmina / creatinina urinaria en una muestra de orina puntual, que es tan precisa pero más conveniente que una recolección de orina de 24 horas.
Se recomienda que los diabéticos se controlen anualmente los niveles de albúmina, comenzando inmediatamente después de un diagnóstico de diabetes tipo 2 y cinco años después de un diagnóstico de diabetes tipo 1. Las imágenes médicas de los riñones, generalmente mediante ecografía , se recomiendan como parte de un diagnóstico diferencial si existe la sospecha de obstrucción del tracto urinario , infección del tracto urinario , cálculos renales o enfermedad renal poliquística . La biopsia renal de conformación solo debe realizarse si se sospecha una enfermedad renal no diabética.
El análisis de orina en pacientes con enfermedad renal diabética suele ser insípido. En casos de microalbuminuria severamente aumentada, puede haber hematuria. Los cuerpos grasos pueden estar presentes en pacientes que desarrollan proteinuria en rango nefrótico.
| Estadio de la ERC | Nivel de eGFR (ml / min / 1,73 m 2 ) |
|---|---|
| Nivel 1 | ≥ 90 |
| Etapa 2 | 60–89 |
| Etapa 3 | 30–59 |
| Etapa 4 | 15-29 |
| Etapa 5 | <15 |
Puesta en escena
Para estadificar el grado de daño en esta (y cualquier otra) enfermedad renal, se determina la creatinina sérica y se usa para calcular la tasa de filtración glomerular estimada ( eGFR ). La TFGe normal es igual o superior a 90 ml / min / 1,73 m 2 .
Biomarcadores
Aunque la albuminuria es el marcador de ND más utilizado, tiene una sensibilidad limitada, ya que muchos pacientes con nefropatía diabética experimentan pérdida de FG y glomeruloesclerosis sin elevación inmediata de la albuminuria. Actualmente se están estudiando muchos marcadores nuevos que potencialmente detectan la nefropatía diabética en etapas más tempranas e identifican el riesgo de progresión. La cistatina C es una proteína que se filtra libremente en los glomérulos antes de reabsorberse y catabolizarse en las células de los túbulos renales. Su nivel sérico es independiente de la masa muscular, lo que lo hace más preciso para estimar la TFG que los niveles séricos de creatinina.
Tratamiento
Los objetivos del tratamiento son retrasar la progresión del daño renal y controlar las complicaciones relacionadas. El tratamiento de la nefropatía diabética se centra actualmente en cuatro áreas principales: reducción del riesgo cardiovascular, control glucémico, control de la presión arterial e inhibición del sistema RAAS.
Reducción del riesgo cardiovascular: los pacientes con diabetes mellitus tienen un riesgo significativamente mayor de enfermedad cardiovascular, que también es un factor de riesgo independiente de insuficiencia renal. Por tanto, es importante gestionar de forma agresiva los factores de riesgo cardiovascular en pacientes con diabetes mellitus y, en particular, en aquellos con nefropatía diabética. Los componentes principales del manejo de las enfermedades cardiovasculares son el abandono del tabaco, las terapias para reducir los lípidos (p. Ej., Estatinas), así como el ejercicio regular y una alimentación saludable. En pacientes con enfermedad renal, se prefiere la atorvastatina sobre otras estatinas, ya que no requiere ajuste de dosis según la TFG.
Control glucémico: varios estudios han encontrado un efecto positivo de un mejor control glucémico en los resultados clínicos de los pacientes con nefropatía diabética. El control glucémico intensivo también reduce la tasa de otras complicaciones de la DM, como la retinopatía y la neuropatía. El control glucémico se mantiene principalmente con insulina en pacientes con DM tipo 1 y con agentes hipoglucemiantes y / o insulina en pacientes con DM tipo 2. Los estudios mostraron una disminución de las complicaciones microvasculares de la nefropatía diabética con un objetivo de concentración de HbA1c del 7%. Una mayor reducción de la HbA1c no se correlacionó con mejores resultados y, por lo tanto, no se recomienda en la mayoría de los pacientes, ya que podría aumentar el riesgo de episodios hipoglucémicos.
Control de la presión arterial: múltiples ensayos clínicos aleatorizados han demostrado el beneficio de disminuir la presión arterial sistólica a <140 mmHg en pacientes con nefropatía diabética. La presión arterial alta se asocia con el desarrollo acelerado de microalbuminuria, sobre proteinuria y deterioro de la función renal. Los inhibidores de la enzima convertidora de angiotensina, así como los bloqueadores del receptor de angiotensina II, son particularmente útiles en pacientes con diabetes para disminuir la presión arterial y retrasar la progresión de la nefropatía. Se ha demostrado que una presión arterial más baja (125-130 / <80) en pacientes con diabetes mellitus disminuye el riesgo de progresión de la nefropatía diabética, así como otras complicaciones diabéticas. Algunos pacientes pueden requerir terapia dual para controlar adecuadamente la presión, en cuyo caso los bloqueadores de los canales de calcio o los diuréticos son una buena opción de segunda línea.
Inhibición del RAAS: la inhibición se puede lograr con múltiples terapias, principalmente inhibidores de la ECA, bloqueadores de los receptores de angiotensina, inhibidores directos de la renina y antagonistas de mineralocorticoides. Se ha demostrado que la inhibición de RAAS es la terapia más eficaz para retardar la progresión de la nefropatía diabética en todas las etapas. Aunque el bloqueo del RAAS utilizando más de un agente puede reducir aún más la proteinuria, el riesgo de eventos adversos (como hiperpotasemia, lesión renal aguda) supera los posibles beneficios. Por tanto, se recomienda que solo se utilice un fármaco en pacientes con DM que presenten hipertensión o cualquier signo de microalbuminuria o nefropatía diabética.
Aproximadamente la mitad de la insulina es metabolizada y eliminada por los riñones. Esto significa que a medida que la función renal empeora en el contexto de la ND, algunos pacientes con DM insulinodependiente pueden encontrar que sus dosis regulares de insulina duran más de lo normal o que experimentan una frecuencia cada vez mayor de episodios hipoglucémicos. También es crucial monitorear de cerca la función renal para dosificar adecuadamente los medicamentos que son eliminados por los riñones. Algunos de los medicamentos nefrotóxicos más utilizados son los medicamentos antiinflamatorios no esteroideos (AINE) como el ibuprofeno. Con el empeoramiento de la función renal, también podría ser necesario seguir una dieta renal para evitar complicaciones como la hiperpotasemia y la acidosis metabólica. Alguna evidencia sugiere que limitar la proteína en la dieta podría retrasar la progresión de la ND, pero se necesitan más pruebas para confirmar este beneficio. Los pacientes con nefropatía diabética pueden desarrollar una enfermedad renal en etapa terminal y requerir un trasplante de riñón o hemodiálisis.
Terapias emergentes
Un medicamento relativamente nuevo que ha sido aprobado para el tratamiento de la DM son los inhibidores del cotransportador 2 de glucosa y sodio (SGLT2). El mecanismo de acción de este fármaco es el cotransportador de captación de sodio-glucosa en el túbulo proximal, generando así naturesis y glucosuria. En múltiples ensayos clínicos, los inhibidores de SGLT2 mostraron mejores resultados cardiovasculares en pacientes con DM, así como un efecto positivo sobre los resultados renales, principalmente una reducción de la albuminuria y la progresión del daño renal. Otras clases de medicamentos para la diabetes que han demostrado tener un efecto positivo en la progresión de la nefropatía diabética son los agonistas de GLP-1 y los inhibidores de DPP-4.
Pronóstico
La nefropatía diabética en la diabetes tipo 2 puede ser más difícil de predecir porque la aparición de la diabetes no suele estar bien establecida. Sin intervención, 20 a 40 por ciento de los pacientes con diabetes tipo 2 / microalbuminuria evolucionarán a macroalbuminuria. La nefropatía diabética es la causa más común de enfermedad renal en etapa terminal , que puede requerir hemodiálisis o incluso trasplante de riñón . Se asocia con un mayor riesgo de muerte en general, particularmente por enfermedad cardiovascular .
Epidemiología
La nefropatía diabética afecta aproximadamente a un tercio de los pacientes con diabetes mellitus tipo 1 y tipo 2. La nefropatía diabética es responsable de aproximadamente un tercio de los casos de ESRD en todo el mundo y una fracción aún mayor en los países desarrollados. En todo el mundo, se prevé que la prevalencia de la diabetes aumente de 382 millones en 2013 a más de 592 millones en 2035. Se prevé que este aumento sea más pronunciado en los países desarrollados. La prevalencia de DM tipo 2 está aumentando particularmente debido a la creciente prevalencia de obesidad en todo el mundo. La progresión de la enfermedad renal diabética podría conducir a la ESRD, así como a un mayor riesgo de complicaciones cardiovasculares, todas las cuales causan una carga económica sustancial. El costo estimado del manejo de pacientes con ESRD debido a nefropatía diabética en los EE. UU. Es de 39,35 mil millones de dólares en 2010. En los países desarrollados, ciertos grupos étnicos como los afroamericanos y los nativos americanos tienen un mayor riesgo de desarrollar nefropatía diabética y ESRD.
Ver también
Referencias
Otras lecturas
- "Efectos de los bloqueadores del sistema renina-angiotensina sobre los resultados renales y la mortalidad por todas las causas en pacientes con nefropatía diabética: un metanálisis actualizado" . www.crd.york.ac.uk . Consultado el 2 de julio de 2015 .
- Gross JL, de Azevedo MJ, Silveiro SP, Canani LH, Caramori ML, Zelmanovitz T (enero de 2005). "Nefropatía diabética: diagnóstico, prevención y tratamiento" . Cuidado de la diabetes . 28 (1): 164–76. doi : 10.2337 / diacare.28.1.164 . PMID 15616252 .
- Tziomalos K, Athyros VG (2015). "Nefropatía diabética: nuevos factores de riesgo y mejoras en el diagnóstico" . La revisión de estudios diabéticos . 12 (1–2): 110–8. doi : 10.1900 / RDS.2015.12.110 . PMC 5397986 . PMID 26676664 .
- Kume S, Koya D, Uzu T, Maegawa H (2014). "Papel de las señales de detección de nutrientes en la patogénesis de la nefropatía diabética" . BioMed Research International . 2014 : 315494. doi : 10.1155 / 2014/315494 . PMC 4122096 . PMID 25126552 .
- Doshi SM, Friedman AN (agosto de 2017). "Diagnóstico y manejo de la enfermedad renal diabética tipo 2" . Revista clínica de la Sociedad Estadounidense de Nefrología . 12 (8): 1366-1373. doi : 10.2215 / CJN.11111016 . PMC 5544517 . PMID 28280116 .
enlaces externos
| Clasificación | |
|---|---|
| Recursos externos |
| Scholia tiene un perfil de tema para la nefropatía diabética . |
