Combustión en bucle químico - Chemical looping combustion
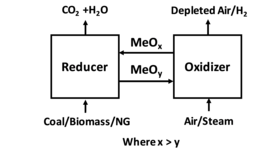
La combustión en bucle químico ( CLC ) es un proceso tecnológico que generalmente emplea un sistema de lecho fluidizado dual . También se ha empleado como proceso tecnológico el CLC operado con un lecho móvil interconectado con un sistema de lecho fluidizado. En CLC, se emplea un óxido metálico como material de lecho que proporciona el oxígeno para la combustión en el reactor de combustible . A continuación, el metal reducido se transfiere al segundo lecho ( reactor de aire ) y se vuelve a oxidar antes de volver a introducirse en el reactor de combustible completando el ciclo. La figura 1 muestra un diagrama simplificado del proceso CLC. La figura 2 muestra un ejemplo de un sistema de reactor de circulación de lecho fluidizado dual y un sistema de reactor de circulación de lecho fluidizado de lecho móvil.
El aislamiento del combustible del aire simplifica el número de reacciones químicas en la combustión . El empleo de oxígeno sin nitrógeno y los gases traza que se encuentran en el aire elimina la fuente principal para la formación de óxido de nitrógeno ( NO
X ), produce un gas de combustión compuesto principalmente por dióxido de carbono y vapor de agua ; otros contaminantes traza dependen del combustible seleccionado.
Descripción
La combustión en bucle químico (CLC) utiliza dos o más reacciones para realizar la oxidación de combustibles a base de hidrocarburos. En su forma más simple, una especie portadora de oxígeno (normalmente un metal) se oxida primero en el aire formando un óxido. A continuación, este óxido se reduce utilizando un hidrocarburo como reductor en una segunda reacción. Como ejemplo, un sistema a base de hierro que queme carbono puro implicaría las dos reacciones redox :
-
C (s) + Fe
2O
3(s) → Fe
3O
4(s) + CO
2(gramo)( 1 )
-
( 2 )
Si se suman ( 1 ) y ( 2 ), el conjunto de reacción se reduce a oxidación directa de carbono, es decir:
-
C (s) + O
2(g) → CO
2(gramo)( 3 )
El CLC se estudió por primera vez como una forma de producir CO
2de combustibles fósiles, utilizando dos lechos fluidizados interconectados. Posteriormente se propuso como un sistema para incrementar la eficiencia de la central eléctrica. La ganancia en eficiencia es posible debido a la reversibilidad mejorada de las dos reacciones redox; En la combustión tradicional de una sola etapa, la liberación de la energía de un combustible ocurre de una manera altamente irreversible, desviándose considerablemente del equilibrio. En la CLC, si se elige un portador de oxígeno apropiado, se puede hacer que ambas reacciones redox se produzcan de forma casi reversible y a temperaturas relativamente bajas. En teoría, esto permite que una central eléctrica que utiliza CLC se acerque a la salida de trabajo ideal para un motor de combustión interna sin exponer los componentes a temperaturas de trabajo excesivas.
Termodinámica
La figura 3 ilustra los intercambios de energía en un sistema CLC gráficamente y muestra un diagrama de Sankey de los flujos de energía que ocurren en un motor basado en CLC reversible. Al estudiar la figura 1, se dispone un motor térmico para recibir calor a altas temperaturas de la reacción de oxidación exotérmica . Después de convertir parte de esta energía en trabajo, el motor térmico rechaza la energía restante en forma de calor. Casi todo este rechazo de calor puede ser absorbido por la reacción de reducción endotérmica que ocurre en el reductor. Esta disposición requiere que las reacciones redox sean exotérmicas y endotérmicas respectivamente, pero este suele ser el caso de la mayoría de los metales. Se requiere cierto intercambio de calor adicional con el medio ambiente para satisfacer la segunda ley ; teóricamente, para un proceso reversible, el intercambio de calor está relacionado con el cambio de entropía de estado estándar, ΔS o , de la reacción de oxidación del hidrocarburo primario de la siguiente manera:
- Q o = T o ΔS o
Sin embargo, para la mayoría de los hidrocarburos, ΔS o es un valor pequeño y, como resultado, un motor de alta eficiencia general es teóricamente posible.
Captura de CO 2
Aunque propuesto como un medio para aumentar la eficiencia, en los últimos años se ha mostrado interés en el CLC como técnica de captura de carbono . La captura de carbono se ve facilitada por CLC porque las dos reacciones redox generan dos corrientes de gas de combustión intrínsecamente separadas: una corriente del reactor de aire, que consta de N atmosférico
2y O residual
2, pero sensiblemente libre de CO
2; y una corriente del reactor de combustible que contiene predominantemente CO
2y H
2O con muy poco nitrógeno diluyente. El gas de combustión del reactor de aire se puede descargar a la atmósfera causando un mínimo de CO
2contaminación. El gas de salida del reductor contiene casi todo el CO
2generado por el sistema y el CLC, por lo tanto, se puede decir que exhibe una 'captura de carbono inherente', ya que el vapor de agua se puede eliminar fácilmente del segundo gas de combustión a través de la condensación, lo que lleva a una corriente de CO casi puro
2. Esto le da a CLC claros beneficios en comparación con las tecnologías de captura de carbono de la competencia, ya que estas últimas generalmente implican una penalización energética significativa asociada con los sistemas de depuración de postcombustión o con el trabajo requerido para las plantas de separación de aire. Esto ha llevado a que CLC se proponga como una tecnología de captura de carbono energéticamente eficiente, capaz de capturar casi todo el CO 2 , por ejemplo, de una planta Coal Direct Chemical Looping (CDCL). Los resultados de una demostración continua de 200 horas de una unidad sub-piloto CDCL de 25 kW th indicaron una conversión de carbón de casi el 100% en CO 2 sin arrastre de carbón al reactor de aire.
Desarrollo tecnológico
La primera operación de combustión en bucle químico con combustibles gaseosos se demostró en 2003, y luego con combustibles sólidos en 2006. La experiencia operativa total en 34 pilotos de 0,3 a 3 MW es de más de 9000 h. Los materiales portadores de oxígeno usados en la operación incluyen óxidos monometálicos de níquel, cobre, manganeso y hierro, así como varios óxidos combinados que incluyen óxidos de manganeso combinados con calcio, hierro y sílice. También se han utilizado minerales naturales, especialmente para combustibles sólidos, incluidos minerales de hierro, minerales de manganeso e ilmenita.
Penalización de costo y energía
Una evaluación detallada de la tecnología de la combustión en bucle químico de combustible sólido, es decir, carbón, para una central eléctrica de 1000 MW th muestra que los costos adicionales del reactor CLC en comparación con una caldera de lecho fluidizado circulante normal son pequeños, debido a las similitudes de las tecnologías. Los principales costos son en cambio la compresión de CO 2 , necesaria en todas las tecnologías de captura de CO 2 , y la producción de oxígeno. La producción de oxígeno molecular también puede ser necesaria en ciertas configuraciones de CLC para pulir el gas producto del reactor de combustible. En total, los costes añadidos se estimaron en 20 € / tonelada de CO 2, mientras que la penalización energética fue del 4%.
Una variante de CLC es la combustión en bucle químico con desacoplamiento de oxígeno (CLOU), en la que se utiliza un portador de oxígeno que libera oxígeno en fase gaseosa en el reactor de combustible, por ejemplo, CuO / Cu.
2O. Esto es útil para lograr una alta conversión de gas, y especialmente cuando se utilizan combustibles sólidos, donde se puede evitar la gasificación lenta de los carbonizados con vapor. El funcionamiento de CLOU con combustibles sólidos muestra un alto rendimiento
El bucle químico también se puede utilizar para producir hidrógeno en procesos de reforma de bucle químico (CLR). En una configuración del proceso CLR, el hidrógeno se produce a partir de carbón y / o gas natural utilizando un reactor de combustible de lecho móvil integrado con un reactor de vapor y un reactor de aire de lecho fluidizado. Esta configuración de CLR puede producir más de un 99% de pureza H 2 sin la necesidad de CO 2 separación.
En revisiones recientes sobre tecnologías de bucle químico se ofrecen descripciones generales completas del campo.
En resumen, CLC puede lograr un aumento en la eficiencia de la central eléctrica simultáneamente con una captura de carbono de baja penalización por energía. Los desafíos con CLC incluyen la operación de lecho fluidizado dual (manteniendo la fluidización del portador mientras se evita el aplastamiento y el desgaste) y el mantenimiento de la estabilidad del portador durante muchos ciclos.
Ver también
- Reformado y gasificación de bucles químicos
- Combustión
- Combustión de oxicombustible
- Agente oxidante
- Redox (reacción de reducción / oxidación)
- Captura y almacenamiento de carbono
- Productor de hidrógeno Lane
Referencias
enlaces externos
- http://www.entek.chalmers.se/lyngfelt/co2/co2.htm
- bucle químico en
- Bucle químico , Instituto de Ciencias de la Combustión, Universidad de Western Kentucky.
- http://www.icb.csic.es/index.php?id=144&L=1
- http://www3.imperial.ac.uk/carboncaptureandstorage
- http://www.encapco2.org/sp4.htm Archivado el 21 de abril de 2008 en la Wayback Machine.
- Tecnología de captura de carbono y bucle químico: una actualización sobre el progreso . Grabación del seminario web, Carl Bozzuto and the Global CCS Institute, 11 de julio de 2012.