Catequina - Catechin

|
|
|
|
| Nombres | |
|---|---|
|
Nombre IUPAC
(2 R , 3 S ) -2- (3,4-Dihidroxifenil) -3,4-dihidro- 2H -cromeno-3,5,7-triol
|
|
| Otros nombres
Cianidanol
Cianidanol (+) - catequina D-Catequina Ácido catequínico Ácido catechuico Cianidol Dexcianidanol (2 R , 3 S ) -Catequina 2,3- trans -Catequina (2 R , 3 S ) -Flavan-3,3 ′, 4 ′, 5,7-pentol |
|
| Identificadores | |
|
Modelo 3D ( JSmol )
|
|
| 3DMet | |
| CHEBI | |
| CHEMBL | |
| ChemSpider | |
| Tarjeta de información ECHA |
100.005.297 |
| Número CE | |
| KEGG | |
|
PubChem CID
|
|
| UNII | |
|
Tablero CompTox ( EPA )
|
|
|
|
|
|
| Propiedades | |
| C 15 H 14 O 6 | |
| Masa molar | 290,271 g · mol −1 |
| Apariencia | Sólido incoloro |
| Punto de fusion | 175 a 177 ° C (347 a 351 ° F; 448 a 450 K) |
| UV-vis (λ máx. ) | 276 nanómetro |
|
Rotación quiral ([α] D )
|
+ 14,0 ° |
| Riesgos | |
| Principales peligros | Mutagénico para células somáticas de mamíferos, mutagénico para bacterias y levaduras |
| Ficha de datos de seguridad | Sciencelab AppliChem |
| Pictogramas GHS |

|
| Palabra de señal GHS | Advertencia |
| H315 , H319 , H335 | |
| P261 , P264 , P271 , P280 , P302 + 352 , P304 + 340 , P305 + 351 + 338 , P312 , P321 , P332 + 313 , P337 + 313 , P362 , P403 + 233 , P405 , P501 | |
| Dosis o concentración letal (LD, LC): | |
|
LD 50 ( dosis media )
|
(+) - catequina: 10,000 mg / kg en rata (RTECS) 10,000 mg / kg en ratón 3,890 mg / kg en rata (otra fuente) |
| Farmacología | |
| Oral | |
| Farmacocinética : | |
| Orinas | |
|
Salvo que se indique lo contrario, los datos se proporcionan para materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa). |
|
|
|
|
| Referencias de Infobox | |
La catequina / k æ t ɪ tʃ ɪ n / es un flavan-3-ol , un tipo de fenol natural y antioxidante . Es un metabolito secundario vegetal . Pertenece al grupo de los flavan-3-oles (o simplemente flavonoides ), parte de la familia química de los flavonoides .
El nombre de la familia química de la catequina deriva de catechu , que es el jugo tánico o extracto hervido de Mimosa catechu ( Acacia catechu Lf).
Química
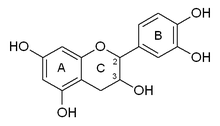
La catequina posee dos anillos de benceno (llamados anillos A y B) y un heterociclo de dihidropirano (el anillo C) con un grupo hidroxilo en el carbono 3. El anillo A es similar a un resto de resorcinol mientras que el anillo B es similar a un resto catecol . Hay dos centros quirales en la molécula de los carbonos 2 y 3. Por lo tanto, tiene cuatro diastereoisómeros . Dos de los isómeros están en configuración trans y se denominan catequina y los otros dos están en configuración cis y se denominan epicatequina .
El isómero de catequina más común es la (+) - catequina. El otro estereoisómero es (-) - catequina o ent -catequina. El isómero de epicatequina más común es (-) - epicatequina (también conocida con los nombres de L-epicatequina, epicatequina, (-) - epicatequina, l-acacatequina, l-epicatequina, epi-catequina, 2,3-cis-epicatequina o ( 2 R , 3 R ) - (-) - epicatequina).
Los diferentes epímeros se pueden distinguir usando cromatografía en columna quiral .
Haciendo referencia a ningún isómero en particular, la molécula puede llamarse simplemente catequina. Las mezclas de los diferentes enantiómeros se pueden llamar (+/-) - catequina o DL-catequina y (+/-) - epicatequina o DL-epicatequina.
La catequina y la epicatequina son los componentes básicos de las proantocianidinas , un tipo de tanino condensado.
- Galería de diastereoisómeros
Además, la flexibilidad del anillo C permite dos isómeros de conformación , colocando el anillo B en una posición pseudoecuatorial (conformador E) o en una posición pseudoaxial (conformador A). Los estudios confirmaron que la (+) - catequina adopta una mezcla de conformadores A y E en solución acuosa y su equilibrio conformacional se ha evaluado en 33:67.
Como flavonoides, las catequinas pueden actuar como antioxidantes cuando están en alta concentración in vitro , pero en comparación con otros flavonoides, su potencial antioxidante es bajo. La capacidad para apagar el oxígeno singlete parece estar en relación con la estructura química de la catequina, con la presencia del resto catecol en el anillo B y la presencia de un grupo hidroxilo que activa el doble enlace en el anillo C.
Oxidación
Los experimentos electroquímicos muestran que el mecanismo de oxidación de (+) - catequina procede en pasos secuenciales, relacionados con los grupos catecol y resorcinol y la oxidación depende del pH. La oxidación de los grupos donantes de electrones de catecol 3 ', 4'-dihidroxilo ocurre primero, a potenciales positivos muy bajos, y es una reacción reversible. Se demostró que los grupos hidroxilo del resto de resorcinol oxidado posteriormente experimentan una reacción de oxidación irreversible.
El sistema lacasa / ABTS oxida (+) - catequina a productos oligoméricos de los cuales la proantocianidina A2 es un dímero.
Datos espectrales
| UV-Vis | |
|---|---|
| Lambda-max : | 276 nanómetro |
| Coeficiente de extinción (log ε) | 4.01 |
| IR | |
| Bandas de absorción principales | 1600 cm −1 (anillos de benceno) |
| RMN | |
|
RMN de protones
|
δ : 2,49 (1H, dd, J = 16,0, 8,6 Hz, H-4a), |
| RMN de carbono 13 | |
| Otros datos de RMN | |
| SRA | |
| Masas de fragmentos principales |
IEN-EM [M + H] + m / z: 291,0
|
Sucesos naturales
(+) - Catequina y (-) - epicatequina, así como sus conjugados de ácido gálico, son componentes ubicuos de las plantas vasculares y componentes frecuentes de los remedios tradicionales a base de hierbas , como Uncaria rhynchophylla . Los dos isómeros se encuentran principalmente como componentes del cacao y del té , así como en las uvas Vitis vinifera .
En la comida
Las principales fuentes dietéticas de catequinas en Europa y Estados Unidos son el té y las frutas de pepita .
Las catequinas y epicatequinas se encuentran en el cacao , que, según una base de datos, tiene el mayor contenido (108 mg / 100 g) de catequinas entre los alimentos analizados, seguido del jugo de ciruela (25 mg / 100 ml) y la vaina de habas (16 mg). /100 gramos). El aceite de açaí , obtenido del fruto de la palma de açaí ( Euterpe oleracea ), contiene (+) - catequinas (67 mg / kg).
Las catequinas son diversas entre los alimentos, desde melocotones hasta té verde y vinagre . Las catequinas se encuentran en el grano de cebada, donde son el principal compuesto fenólico responsable de la decoloración de la masa . El sabor asociado con la (+) - catequina o (-) - epicatequina monomérica se describe como ligeramente astringente , pero no amarga.
Metabolismo
Biosíntesis
La biosíntesis de la catequina comienza con una unidad inicial de ma 4-hidroxicinamoil CoA que experimenta una extensión de cadena mediante la adición de tres malonil-CoAs a través de una ruta PKSIII. La 4-hidroxicinamoil CoA se biosintetiza a partir de L-fenilalanina a través de la vía Shikimate. La L-fenilalanina se desamina primero por la fenilalanina amoniaco liasa (PAL) formando ácido cinámico que luego se oxida a ácido 4-hidroxicinámico por la cinamato 4-hidroxilasa. La calcona sintasa luego cataliza la condensación de 4-hidroxicinamoil CoA y tres moléculas de malonil-CoA para formar calcona . Entonces, la chalcona se isomeriza a naringenina por la chalcona isomerasa que se oxida a eriodictyol por la flavonoide 3'-hidroxilasa y luego se oxida a taxifolina por la flavanona 3-hidroxilasa. Luego, la taxifolina se reduce mediante dihidroflavanol 4-reductasa y leucoantocianidina reductasa para producir catequina. La biosíntesis de catequina se muestra a continuación.
La leucocianidina reductasa (LCR) utiliza 2,3-trans-3,4-cis- leucocianidina para producir (+) - catequina y es la primera enzima en la vía específica de las proantocianidinas (PA). Su actividad se ha medido en hojas, flores y semillas de las leguminosas Medicago sativa , Lotus japonicus , Lotus uliginosus , Hedysarum sulfurescens y Robinia pseudoacacia . La enzima también está presente en Vitis vinifera (uva).
Biodegradacion
La catequina oxigenasa, una enzima clave en la degradación de la catequina, está presente en hongos y bacterias.
Entre las bacterias, Acinetobacter calcoaceticus puede lograr la degradación de (+) - catequina . La catequina se metaboliza a ácido protocatecuico (PCA) y ácido floroglucinol carboxílico (PGCA). También es degradado por Bradyrhizobium japonicum . El ácido floroglucinol carboxílico se descarboxila más a floroglucinol , que se deshidroxila a resorcinol . El resorcinol se hidroxila a hidroxiquinol . El ácido protocatecuico y el hidroxiquinol experimentan escisión intradiol a través de la protocatecuato 3,4-dioxigenasa e hidroxiquinol 1,2-dioxigenasa para formar β-carboxi cis, ácido cis-mucónico y acetato de maleilo .
Entre los hongos, Chaetomium cupreum puede lograr la degradación de la catequina .
Metabolismo en humanos

Las catequinas se metabolizan al ser absorbidas por el tracto gastrointestinal , en particular el yeyuno , y en el hígado , dando lugar a los denominados metabolitos de epicatequina relacionados estructuralmente (SREM). Las principales vías metabólicas para SREMs son glucuronidación , sulfatación y la metilación de la catecol grupo por la catecol-O-metil , con sólo pequeñas cantidades detectados en plasma. Sin embargo, la mayoría de las catequinas de la dieta son metabolizadas por el microbioma colónico a gamma-valerolactonas y ácidos hipúricos que experimentan una mayor biotransformación , glucuronidación , sulfatación y metilación en el hígado .
La configuración estereoquímica de las catequinas tiene un fuerte impacto en su captación y metabolismo, ya que la captación es más alta para (-) - epicatequina y más baja para (-) - catequina.
Biotransformación
La biotransformación de (+) - catequina en taxifolina mediante una oxidación en dos pasos puede lograrse mediante Burkholderia sp.
(+) - Catequina y (-) - epicatequina son transformadas por el hongo filamentoso endofítico Diaporthe sp. en los derivados de 3,4-cis-dihidroxiflavana, (+) - (2R, 3S, 4S) -3,4,5,7,3 ', 4'-hexahidroxiflavana (leucocianidina) y (-) - (2R, 3R , 4R) -3,4,5,7,3 ', 4'-hexahidroxiflavana , respectivamente, mientras que (-) - catequina y (+) - epicatequina con un grupo 2S-fenilo resistieron la biooxidación.
La leucoantocianidina reductasa (LAR) utiliza (2 R , 3 S ) -catequina, NADP + y H 2 O para producir 2,3-trans-3,4-cis- leucocianidina , NADPH y H + . Su expresión genética se ha estudiado en el desarrollo de bayas de uva y hojas de vid.
Glucósidos
- El (2R, 3S) -catequina-7-O-β-D-glucopiranósido se puede aislar de cebada ( Hordeum vulgare L.) y malta.
- El epigeósido (catequina-3-O-alfa-L-ramnopiranosil- (1-4) -beta-D-glucopiranosil- (1-6) -beta-D-glucopiranosido) se puede aislar de los rizomas de Epigynum auritum .
Investigar
Función vascular
Solo la evidencia limitada de estudios dietéticos indica que las catequinas pueden afectar la vasodilatación dependiente del endotelio, lo que podría contribuir a la regulación normal del flujo sanguíneo en humanos. Las catequinas del té verde pueden mejorar la presión arterial, especialmente cuando la presión arterial sistólica es superior a 130 mmHg.
Debido al extenso metabolismo durante la digestión, se desconoce el destino y la actividad de los metabolitos de las catequinas responsables de este efecto en los vasos sanguíneos, así como el modo de acción real.
La Autoridad Europea de Seguridad Alimentaria estableció que los flavonoides del cacao tienen un efecto sobre la función vascular en adultos sanos al concluir: "Los flavonoides del cacao ayudan a mantener la vasodilatación dependiente del endotelio, lo que contribuye al flujo sanguíneo normal". Para que se produzca tal efecto, el consumo diario de 200 mg de flavanoles de cacao, posiblemente de 2,5 g de cacao en polvo con alto contenido de flavanoles o 10 g de chocolate negro con alto contenido de flavanoles, debe ocurrir dentro de una dieta equilibrada.
Otros datos de estudios de cohortes observacionales no mostraron una asociación consistente entre la ingesta de flavan-3-ol y el riesgo de enfermedades cardiovasculares. Un metaanálisis también indicó que las catequinas del té verde pueden afectar favorablemente el colesterol .
Otro
Un metanálisis limitado mostró que aumentar el consumo de té verde y sus catequinas a siete tazas por día proporcionó una pequeña reducción en el cáncer de próstata . Los métodos de nanopartículas se encuentran bajo investigación preliminar como posibles sistemas de administración de catequinas.
Efectos botánicos
Las catequinas liberadas al suelo por algunas plantas pueden dificultar el crecimiento de sus vecinas, una forma de alelopatía . Centaurea maculosa , la mala hierba manchada a menudo estudiada para este comportamiento, libera isómeros de catequina en el suelo a través de sus raíces, lo que podría tener efectos como antibiótico o herbicida . Una hipótesis es que provoca una onda de especies reactivas de oxígeno a través de la raíz de la planta objetivo para matar las células de la raíz por apoptosis . La mayoría de las plantas del ecosistema europeo tienen defensas contra la catequina, pero pocas plantas están protegidas contra ella en el ecosistema norteamericano donde Centaurea maculosa es una maleza invasora y descontrolada.
La catequina actúa como un factor inhibidor de infecciones en las hojas de fresa. La epicatequina y la catequina pueden prevenir la enfermedad del fruto del café al inhibir la melanización apresora de Colletotrichum kahawae .
Referencias
enlaces externos
-
 Medios relacionados con (+) - Catechin en Wikimedia Commons
Medios relacionados con (+) - Catechin en Wikimedia Commons